Сероводород и сероводородная кислота. Соли сероводородной кислоты (сульфиды), их растворимость в воде и взаимодействие с минеральными кислотами. Формула сероводородной кислоты Сероводородная кислота
При нагревании сера реагирует с водородом. Образуется ядовитый газ с резким запахом - сероводород. По-другому называется сернистым водородом, сульфидом водорода, дигидросульфидом.
Строение
Сернистый водород - это бинарное соединение серы и водорода. Формула сероводорода - H 2 S. Строение молекулы аналогично строению молекулы воды. Однако сера образует с водородом не водородную, а ковалентную полярную связь. Это связано с тем, что в отличие от атома кислорода атом серы больше по объёму, имеет меньшую электроотрицательность и меньшую плотность заряда.

Рис. 1. Строение сероводорода.
Получение
Сульфид водорода встречается в природе редко. В небольших концентрациях входит в состав попутных, природных, вулканических газов. Моря и океаны содержат сероводород на больших глубинах. Например, сернистый водород находится на глубине 200 метров в Чёрном море. Кроме того, сероводород выделяется при гниении белков, содержащих серу.
В промышленности получают несколькими способами:
- реакцией кислот с сульфидами:
FeS + 2HCl → FeCl 2 + H 2 S;
- воздействием воды на сульфид алюминия:
Al 2 S 3 + 6H 2 O → 2Al(OH) 3 + 3H 2 S;
- сплавлением серы с парафином:
С 18 Н 38 + 18S → 18H 2 S + 18С.
Наиболее чистый газ получается при прямом взаимодействии водорода и серы. Реакция протекает при 600°С.
Физические свойства
Дигидросульфид - бесцветный газ с запахом протухших яиц и сладковатым вкусом. Это ядовитое вещество, опасное в больших концентрациях. Благодаря молекулярному строению в обычных условиях сернистый водород не сжижается.
Общие физические свойства сернистого водорода:
- плохо растворяется в воде;
- проявляет свойства сверхпроводника при температуре -70°С и давлении 150ГПа;
- огнеопасен;
- растворяется в этаноле;
- сжижается при -60,3°С;
- превращается в твёрдое вещество при -85,6°С;
- плавится при -86°С;
- кипит при -60°С;
- разлагается на простые вещества (серу и водород) при 400°С.
При обычных условиях можно приготовить раствор сероводорода (сероводородную воду). Однако сернистый водород не вступает в реакцию с водой. На воздухе раствор быстро окисляется и мутнеет из-за выделения серы. Сероводородная вода проявляет слабые свойства кислоты.

Рис. 2. Сероводородная вода.
Химические свойства
Сернистый водород - мощный восстановитель. Основные химические свойства вещества описаны в таблице.
|
Реакция |
Описание |
Уравнение |
|
С кислородом |
Горит на воздухе голубым пламенем с образованием диоксида серы. При недостатке кислорода образуется сера и вода |
2H 2 S + 4O 2 → 2H 2 O + 2SO 2 ; 2H 2 S + O 2 → 2S + 2H 2 O |
|
С окислителями |
Окисляется до диоксида серы или серы |
3H 2 S + 4HClO 3 → 3H 2 SO 4 + 4HCl; 2H 2 S + SO 2 → 2H 2 O + 3S; 2H 2 S + H 2 SO 3 → 3S + 3H 2 O |
|
Со щелочами |
При избытке щёлочи образуются средние соли, при отношении 1:1 - кислые |
H 2 S + 2NaOH → Na 2 S + 2H 2 O; H 2 S + NaOH → NaHS + H 2 O |
|
Диссоциации |
Ступенчато диссоциирует в растворе |
H 2 S ⇆ H + + HS – ; HS – ⇆ H + + S 2- |
|
Качественная |
Образование чёрного осадка - сульфида свинца |
H 2 S + Pb(NO 3) 2 → PbS↓ + 2HNO 3 |

Рис. 3. Горение сероводорода.
Сернистый водород - токсичный газ, поэтому его применение ограниченно. Большая часть производимого сероводорода используется в промышленной химии для производства серы, сульфида, серной кислоты.
Что мы узнали?
Из темы урока узнали о строении, получении и свойствах сероводорода или сернистого водорода. Это бесцветный газ с неприятным запахом. Является токсичным веществом. Образует сероводородную воду, не вступая во взаимодействие с водой. В реакциях проявляет свойства восстановителя. Реагирует с кислородом воздуха, сильными окислителями (оксидами, кислородными кислотами), со щелочами. Диссоциирует в растворе в два этапа. Сернистый водород используется в химической промышленности для изготовления производных веществ.
Тест по теме
Оценка доклада
Средняя оценка: 4.4 . Всего получено оценок: 66.
ЧАСТЬ И
ОБЩАЯ ХИМИЯ
ХИМИЯ ЭЛЕМЕНТОВ
ОКСИГЕН. СУЛЬФУР
Сероводород
Молекула сероводорода состоит из атома Серы и двух атомов Водорода, соединенных полярным ковалентной связью. Угол между связями
SH равна 91°. Молекула сероводорода полярная.Сероводород - природный компонент вулканических и природных газов. Некоторые минеральные воды содержащие растворенный сероводород, что придает им лечебных свойств. Сероводород образуется в результате гниения продуктов, содержащих в своем составе белки. В Черном море на глубине более 40 метров нет жизни через насыщенность вод сероводородом.
Физические свойства сероводорода
Сероводород - бесцветный газ с запахом тухлых яиц. В 1 объеме воды растворяется 3 объема сероводорода, при этом образуется примерно 0,1 молярный раствор. Температура плавления сероводорода равна -83 °С, а температура кипения -61 °С. Сероводород влияет на нервную систему человека, поэтому работать с ним необходимо под вытяжной шкафом.
Химические свойства сероводорода
Сероводород является соединением, имеет строение, подобное молекулы воды, однако по сравнению с ней есть менее стабильной. В случае нагрева до высоких температур происходит разложение сероводорода по реакции:
Горения может происходить по двум различным направлениям. В избытке кислорода образуется вода и сульфур(И
V) оксид:По недостатке кислорода происходит неполное сгорание сероводорода. Этот процесс используется для добывания серы в промышленных масштабах из газов, которые образуются во время обжига руд:
Бром и йод восстанавливают сероводород до простого вещества серы:
Сероводород при повышенных температурах реагирует с гексафторсульфуром:
В случае растворения сероводорода в воде образуется слабая двохосновна сульфидная кислота (К a 1 = 10 - 7 , К a 2 = 1,2 ∙ 10 - 13):
Средние соли сульфидной кислоты называются сульфидами (например, K 2 S - это калий сульфид). Известны также кислые соли соответствующей кислоты - гідрогенсульфіди (KHS - калий гідрогенсульфід). Поскольку сульфидная кислота является довольно слабой кислотой, то растворы сульфидов и гідрогенсульфідів подвергаются гидролизу по аниону, и соответственно среда раствора основное:
Сульфиды щелочных и щелочноземельных металлов растворимы в воде, а другие сульфиды не растворимы. Много солей сульфидной кислоты имеют характерную окраску: HgS - красное, Sb 2 S 3 - оранжевое, CdS - желтое, MnS - розовое, CuS - черное.
Добывания и применения сероводорода
Сероводород обычно добывают действием минеральных кислот на сульфиды металлов:
Сероводород также можно добыть и из простых веществ.
Применяют сероводород в качественном анализе катионов по сульфідною классификации. Также он играет важную роль в процессе производства серной кислоты.
Качественная реакция на сероводород i сульфид-ион
Для определение сульфид-ионов в растворе к исследуемому раствору добавляют любую растворимую соль Свинца (чаще всего ацетат Р b (СН 3 СОО) 2 или нитрат Pb (NO 3) 2). Если после добавление в растворе появляется черный осадок, то в исследуемом образце присутствовали сульфид-ионы:
Если о говорят, что он слаб, значит, пришла болезнь, или голод, в общем, невзгоды. В химии все иначе. Рассмотрим слабую сероводородную. Слаба она не потому, что готова распасться, погибнуть а, напротив, из-за нежелания диссоциировать.
Так именуют процесс растворения в воде, разделения на ион гидроксония и анион. Сероводородная диссоциирует всего на 0,011%, причем, в две стадии. На первой из них степень распада не превышает 0,005%.
Так что, является вполне стойкой, «держит удар». Однако, это по человеческим меркам. В химии все иначе. Погрузимся в ее мир, продолжив изучение свойств сероводородной.
Свойства сероводородной кислоты
Стойкость героини относительна. Не желая до конца растворяться в воде, соединение распадается под действием кислорода. Он окисляет сероводородную кислоту. Формула ее выглядит так: - Н 2 S. Н в ней – , S – . Так вот, последний при окислении «вырывается» из формулы. Соединение распадается.
По сути, сероводородная кислота является водным раствором газа. Сероводород известен запахом тухлых яиц и ядовитостью. у вещества нет. Нет и у индикаторных бумажек, побывавших в сероводородной кислоте. Свойство это – еще один указатель на слабость соединения. Сильные окрашивают лакмус в тона.
Характеристика сероводородной кислоты сводится не только к медленному растворению в воде. Прочие реакции с героиней статьи тоже проходят неторопливо. Применительно к человеческому характеру, это, скорее, лень, чем слабость.
С металлами, к примеру, сероводородный раствор реагирует нехотя. Объяснение тому – малая концентрация положительных ионов водорода. Их дефицит связан с малой степенью диссоциации.
Из металлов героиня статьи взаимодействует лишь с теми, которые в ряду напряжения стоят до Н 2 . Такие элементы способны вытеснять водород из раствора. Взаимодействие может привести к образованию соли сероводородной кислоты .
Она полностью нерастворима в воде. Реплика касается сульфидов. Это один из типов, образуемых при участии сероводородного соединения. Второй тип – гидросульфиды. Они образуются в ходе реакции с щелочными и щелочноземельными, растворимы.
Вступая во взаимодействие со щелочноземельными металлами, сероводородная реагирует и со щелочами. Героиня статьи выступает восстановителем, то есть, отдает электроны. Получается, свойства соединения типичны для слабого типа.
Неоднозначно другое. Являясь раствором ядовитого сероводорода, героиня статьи опасна лишь относительно. За счет малой концентрации исходного вещества, становится лекарством. Где и как его применяют, расскажем в следующей главе.
Применение сероводородной кислоты
Диссоциация сероводородной кислоты до раствора насыщенностью в тысячные процента позволяет использовать соединение для лечебных. Их, как правило, организуют на местах выхода подземных вод , содержащих сероводород. Запах тухлых яиц терпят ради избавления от кожных недугов, реабилитации системы, лечения бессонницы.
Ванны с сероводородной улучшают кровоток, а значит, благотворно влияют на весь организм. Быстрее передвигаясь по сосудам, кровь не застаивается, оперативнее снабжает органы необходимыми им элементами. Ускоряется обмен веществ, приводя к очищению от шлаков. На общий эффект омоложения.
«На лицо» употреблено в прямом значении. Косметологи применяют раствор сероводорода для лифтинг-процедур. Кроме подтяжки, можно избавиться от целлюлита и угревой сыпи. Локальное нанесение раствора имеет меньше противопоказаний, чем ванны.
Медики замечают, что ванны с сероводородом не принимают в домашних условиях и, вообще, закрытых помещениях. Концентрация паров, исходящих от воды, может превысить допустимые.
В санаториях бассейны стараются расположить под открытым небом. Источники горячие. Поэтому, купаться в них приятно даже зимой. Ряд сероводородных курортов есть, к примеру, вблизи города Северобайкальск.
Врачи, курирующие постояльцев, рекомендуют героиню статьи еще и в качестве лекарства от недугов мочеполовой системы. Правда, беременным и кормящим процедуры противопоказаны. Зато, тем, кто хочет стать родителем, ванны с сероводородом не повредят.
На западе страны сероводород образуется вдоль шельфа Черного моря. Правда, там соединение образуется на глубине около 150-ти метров, выходя пузырьками на мелководье.
Если временные процедуры в атмосфере газа приемлемы, то длительное вдыхание сероводорода ведет к угасанию способности чувствовать запахи. Это итог паралича обонятельного нерва.
Как распознать сероводородную кислоту в воздухе при малой концентрации, в отсутствии явного запаха? Поможет лишь. Она тоже ядовита, но, иначе никак. В реактиве смачивают. В атмосфере с содержанием сероводорода хотя бы в 0,0000001% лист покроется налетом.
Получение сероводородной кислоты
Раз является раствором сероводорода, стоит задаться вопросом его получения. Популярен способ использования и сульфида. В качестве последнего берут природные минералы. Сульфидов в недрах планеты несколько. Самый известный, пожалуй, . Его формула: - FeS 2 .
Реакция между сульфидом и бурная, с активным выделением газа. Соответственно, взаимодействие проводят в изолированных помещениях, используя защитные и одежды.
Промышленники чаще идут другим путем. Сероводород – побочный продукт многих производств. Остается лишь вытянуть вещество из промышленных газов, очистка которых, все равно, прямая обязанность предприятий.
Потом, сероводород растворяют в воде. Жидкость нагревают. Так диссоциация проходит успешнее. Героиня статьи готова к использованию, или продаже. Узнаем ценники.
Цена сероводородной кислоты
Поскольку в быту героиня статьи нужна лишь для водных процедур, форма продажи соединения сводится к для сероводородных ванн . Пример: - средство «Мацеста». Продается в аптеках, как и прочие препараты группы.
«Мацеста» реализуется в пакетах, добавляется в ванну с водой температурой в 37-38 градусов Цельсия. Препарат тщательно размешивают и погружаются на 5-15 минут. Стоит удовольствие около 300-от за пакет, то есть, одну процедуру.
Замечание об опасности принятия сероводородных ванн в домашних условиях никто не отменял. Но, производители перестраховываются, подбирая оптимальную, безопасную концентрацию. При ней, за 15 минут не нанести.
Для лабораторных нужд и промышленных производств нет смысла платить за воду с минимальной долей сероводорода. Удобнее организовать поставки сжиженного газа в баллонах и самим сделать. Товар специфический, спрос ограничен. Поэтому, предложений немного, а на баллоны с газом, как правило, договорная.
РАЗДЕЛ II. НЕОРГАНИЧЕСКАЯ ХИМИЯ
9.3. Элементы VIA группы
9.3.7. Сероводород (сульфид водорода). Сероводородная (сульфидная) кислота. Сульфиды 2
Сероводород и сероводородная кислота Сероводород или сульфид водорода H 2 S ,- летучее соединение Серы с Гідрогеном. В молекуле сероводорода атом Серы образует две ковалентные полярные связи с двумя атомами Водорода. Валентный угол составляет 92,1°. Раствор H 2 S в воде называют сероводородной кислотой.
Распространенность сероводорода в природе
В природе сероводород встречается в составе природных и вулканических газов, содержится в воде некоторых минеральных источников, также образуется при разложении органических веществ (растительных и животных остатков), а потому в небольшом количестве содержится в воздухе.
Огромные запасы сероводорода накопленные в глубинах Черного моря: его слой начинается с глубины 150-200 м и достигает дна (максимальная глубина - 2210 м). Концентрация сероводорода на глубине 150 м - 0,19 мг/л морской воды, на глубине 200 м - 0,83 мг/л, а на глубине 2000 м достигает 9,60 мг/л. Таким образом, за исключением некоторых специфических микроорганизмов, там почти нет живых существ.
Физические свойства и физиологическое действие сероводорода
Сероводород - бесцветный газ с резким неприятным запахом тухлых яиц - вич воды растворяется до 2,5 л H 2 S . Сероводород очень ядовит. Наличие в воздухе объемной доли 0,1 % вызывает отравление. Гидроген сульфид связывает гемоглобин, образуя с ионом Fe 2+ , входящей в его состав, малорозчинну соединение - феррум(II) сульфид.
Добыча сероводорода
В лаборатории для извлечения сероводорода используют реакцию между сульфидом металлического элемента и хлоридной кислотой или разбавленной серной кислотой:
В промышленности сероводород добывают, пропуская водород над расплавленной серой:
Химические свойства сероводорода и сульфидной кислоты
Сероводород
1. Сероводород горит голубоватым пламенем:
При недостатке кислорода образуется сера:
2. Сероводород относят к сильным восстановителям - он может окисляться до серы, сульфур(И V ) оксида или серной кислоты:
3. Сульфид водорода взаимодействует с кислотами-окислителями:
4. Реагирует и с сильными, и со слабыми окислителями:
Использование сероводорода
1. В химической промышленности для получения серной кислоты, элементарной серы, сульфидов.
2. В органическом синтезе серосодержащих веществ (тиолов 3).
3. Как реагент в аналитической химии для обнаружения ионов тяжелых металлических элементов (Ag + , Pb 2+ , С u 2+).
4. В перспективе возможно использование гигантских запасов сероводорода, которые содержатся в Черном море для нужд сероводородной энергетики и химической промышленности.
5. В медицине природные источники и искусственные ванны, содержащие сероводород, используют для борьбы с кожными заболеваниями.
Сульфидная кислота
Раствор сероводорода в воде - сероводородная вода , или сероводородная (сульфидная) кислота - слабая двохосновна кислота. Она слабее сульфітну кислоту H 2 SO 3 . Диссоциирует двоступенево (за II степенью - в незначительной степени):
Сульфидная кислота проявляет общие свойства кислот. Она реагирует с основными оксидами, основаниями, образуя средние и кислые соли, а также с некоторыми солями и металлами:
Соли сероводородной кислоты
Сероводородная кислота образует два ряда солей: средние - сульфиды (K 2 S , CaS) - и кислые - гідроґенсульфіди (KHS , Ca (HS ) 2). Растворимыми в воде сульфиды щелочных и щелочноземельных металлических элементов, а также аммоний сульфид (NH 4) 2 S . Некоторые сульфиды имеют характерную окраску: черное - PbS и CuS , желтое - CdS , белое - ZnS , MgS , розовое - MnS .
Химические свойства сульфидов
1. Растворимые в воде сульфиды медленно гидролизуют, то есть разлагаются водой:
В результате полного гидролиза в растворе некоторые сульфиды получить невозможно:
2. Сульфиды реагируют с некоторыми другими солями:
Эти две реакции являются качественными на обнаружение сульфид-иона S 2- , ведь наблюдается образование характерных осадков черного цвета - CuS и PbS .
3. Сульфиды разлагаются сильными кислотами:
4. Сульфиды при взаимодействии с окислителями проявляют восстановительные свойства:
______________________________________________________________
1 Реакцию используют для связывания разлитой ртути (демеркуризация). Участок пола, где разбился ртутный термометр, необходимо посыпать порошком серы. Киноварь - неядовитая соединение. Она не испаряется (при комнатной температуре) и легко может быть собрана.
2 Полисульфиды - соединения Серы с общей формулой X 2 S n , структура которых содержит цепочки атомов - S - S (n -2) - S -, где, в зависимости от компонента X, n может варьироваться: в полісульфідах Водорода H 2 S n (оліїсті жидкости в зависимости от содержания Серы от желтого до красного цвета) п изменяется от 2 до 23, в полісульфідах аммония ( NH 4) 2 S n - от 2 до 9, щелочных металлов Me 2 S n - от 2 до 8. Их используют в кожевенной промышленности для удаления волос с кожи), в производстве красителей, полисульфидных каучуков, в аналитической химии.
3 Тіоли (или меркаптаны) имеют сильный неприятный запах . В частности, егантіол C 2 H 5 SH добавляют к природному газу (метану запаха нет) перед его подачей в бытовой газопровод, чтобы обнаружить утечки газа из системы.
Химическое строение молекул H 2 S аналогично строению молекул Н 2 O: (угловая форма)
Но, в отличие от воды, молекулы H 2 S малополярны; водородные связи между ними не образуются; прочность молекул значительно ниже.
Физические свойства
При обычной температуре H 2 S - бесцветный газ с чрезвычайно неприятным удушливым запахом тухлых яиц, очень ядовитый (при концентрации > 3 г/м 3 вызывает смертельное отравление). Сероводород тяжелее воздуха, легко конденсируется в бесцветную жидкость.H 2 S растворим в воде (при обычной температуре в 1 л H 2 O растворяется - 2,5 л газа).
Сероводород в природе
H 2 S присутствует в вулканических и подземных газах, в воде серных источников. Он образуется при гниении белков, содержащих серу, а также выделяется в процессе жизнедеятельности многочисленных микроорганизмов.
Способы получения
1. Синтез из простых веществ:
S + Н 2 = H 2 S
2. Действие неокисляющих кислот на сульфиды металлов:
FeS + 2HCI = H 2 S + FeCl 2
3.Действие конц. H 2 SO 4 (без избытка) на щелочные и щелочно-земельные Me:
5H 2 SO 4 (конц.) + 8Na = H 2 S + 4Na 2 SO 4 + 4H 2 О
4. Образуется при необратимом гидролизе некоторых сульфидов:
AI 2 S 3 + 6Н 2 О = 3H 2 S + 2Аl(ОН) 3 ↓
Химические свойства H 2 S
H 2 S - сильный восстановитель
Взаимодействие H 2 S с окислителями приводит к образованию различных веществ (S, SО 2 , H 2 SO 4),
Реакции с простыми веществами окислителями
Окисление кислородом воздуха
2H 2 S + 3О 2 (избыток) = 2SО 2 + 2Н 2 О
2H 2 S + О 2 (недостаток) = 2S↓ + 2Н 2 О
Окисление галогенами:
H 2 S + Br 2 = S↓ + 2НВr
Реакции с окисляющими кислотами (HNО 3 , H 2 SO 4 (конц.).
3H 2 S + 8HNО 3 (разб.) = 3H 2 SO 4 + 8NO + 4Н 2 О
H 2 S + 8HNО 3 (конц.) = H 2 SO 4 + 8NО 2 + 4Н 2 О
H 2 S + H 2 SO 4 (конц.) = S↓ + SО 2 + 2Н 2 О
Реакции с солями - окислителями
5H 2 S + 2KMnO 4 + 3H 2 SO 4 = 5S↓ + 2MnSO 4 + K 2 SO 4 + 8Н 2 О
5H 2 S + 6KMnO 4 + 9H 2 SO 4 = 5SО 2 + 6MnSO 4 + 3K 2 SO 4 + 14Н 2 О
H 2 S + 2FeCl 3 = S↓ + 2FeCl 2 + 2HCl
Водный раствор H 2 S проявляет свойства слабой кислоты
Сероводородная кислота H 2 S 2-основная кислота диссоциирует ступенчато
1-я ступень: H 2 S → Н + + HS -
2-я ступень: HS - → Н + + S 2-
Для H 2 S в водном растворе характерны реакции, общие для класса кислот, в которых она ведет себя как слабая кислота. Взаимодействует:
а) с активными металлами
H 2 S + Mg = Н 2 + MgS
б) с малоактивными металлами (Аg, Си, Нg) в присутствии окислителей
2H 2 S + 4Аg + O 2 = 2Ag 2 S↓ + 2Н 2 O
в) с основными оксидами
H 2 S + ВаО = BaS + Н 2 O
г) со щелочами
H 2 S + NaOH(недостаток) = NaHS + Н 2 O
д) с аммиаком
H 2 S + 2NH 3 (избыток) = (NH 4) 2 S
Особенности реакций H 2 S с солями сильных кислот
Несмотря на то, что сероводородная кислота - очень слабая, она реагирует с некоторыми солями сильных кислот, например:
CuSO 4 + H 2 S = CuS↓ + H 2 SO 4
Реакции протекают в тех случаях, если образующийся сульфид Me нерастворим не только в воде, но и в сильных кислотах.
Качественная реакция на сульфид-анион
Одна из таких реакций используется для обнаружения анионов S 2- и сероводорода:
H 2 S + Pb(NO 3) 2 = 2HNO 3 + PbS↓ черный осадок.
Газообразный H 2 S обнаруживают с помощью влажной бумаги, смоченной раствором Pb(NO 3) 2 , которая чернеет в присутствии H 2 S.
Сульфиды
Сульфидами называют бинарные соединения серы с менее ЭО элементами, в том числе с некоторыми неметаллами (С, Si, Р, As и др.).
Наибольшее значение имеют сульфиды металлов, поскольку многие из них представляют собой природные соединения и используются как сырье для получения свободных металлов, серы, диоксида серы.
Обратимый гидролиз растворимых сульфидов
Сульфиды щелочных Me и аммония хорошо растворимы в воде, но в водном растворе они подвергаются гидролизу в очень значительной степени:
S 2- + H 2 O → HS - + ОН -
Поэтому растворы сульфидов имеют сильнощелочную реакцию
Сульфиды щелочно-земельных Me и Mg, взаимодействуя с водой, подвергаются полному гидролизу и переходят в растворимые кислые соли - гидросульфиды:
2CaS + 2НОН = Ca(HS) 2 + Са(ОН) 2
При нагревании растворов сульфидов гидролиз протекает и по 2-й ступени:
HS - + H 2 O → H 2 S + ОН -
Необратимый гидролиз сульфидов
Сульфиды некоторых металлов подвергаются необратимому гидролизу и полностью разлагаются в водных растворах, например:
Al 2 S 3 + 6H 2 O = 3H 2 S + 2AI(OH) 3↓
Аналогичным образом разлагаются Cr 2 S 3 , Fe 2 S 3
Нерастворимые сульфиды
Большинство сульфидов тяжелых металлов в воде практически не растворяются и поэтому гид ролизу не подвергаются. Некоторые из них растворяются под действием сильных кислот, например:
FeS + 2HCI = FeCl 2 + H 2 S
ZnS + 2HCI = ZnCl 2 + H 2 S
Сульфиды Ag 2 S, HgS, Hg 2 S, PbS, CuS не pacтворяются не только в воде, но и во многих кислотах.
Окислительный обжиг сульфидов
Окисление сульфидов кислородом воздуха при высокой температуре является важной стадией переработки сульфидного сырья. Примеры:
2ZnS + 3O 2 = 2ZnO + 2SO 2
4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2
Способы получения сульфидов
1. Непосредственное соединение простых веществ:
2.Взаимодействие H 2 S с растворами щелочей:
H 2 S + 2NaOH = 2H 2 O + Na 2 S сульфид натрия
H 2 S + NaOH = H 2 O + NaHS гидросульфид натрия
3.Взаимодействие H 2 S или (NH 4) 2 S с растворами солей:
H 2 S + CuSO 4 = CuS↓ + H 2 SO 4
H 2 S + 2AgNO 3 = Ag2S↓ + 2HNO 3
4. Восстановление сульфатов прокаливанием с углем:
Na 2 SO 4 + 4С = Na 2 S + 4СО
Этот процесс используют для получения сульфидов щелочных и щелочно-земельных металлов.
Сероводород (H₂S) представляет собой бесцветный газ c запахом тухлых яиц. По плотности он тяжелее водорода. Сероводород смертельно ядовит для человека и животных. Даже незначительное его содержание в воздухе вызывает головокружение и тошноту, но самым страшным является то, что при длительном его вдыхании этот запах уже не ощущается. Однако при отравлении сероводородом существует простое противоядие: следует завернуть в платок кусок хлорной извести, затем смочить, и какое-то время нюхать этот сверток. Сероводород получают путем взаимодействия серы с водородом при температуре 350 °С:
H₂ + S → H₂S
Это окислительно-восстановительная реакция: в ходе нее изменяются степени окисления участвующих в ней элементов.
В лабораторных условиях сероводород получают воздействием на сульфид железа серной или соляной кислоты:
FeS + 2HCl → FeCl₂ + H₂S
Это реакция обмена: в ней взаимодействующие вещества обмениваются своими ионами. Данный процесс обычно проводят с помощью аппарата Киппа.
 Аппарат Киппа
Аппарат Киппа
Свойства сероводорода
При горении сероводорода образуется оксид серы 4 и водяной пар:
2H₂S + 3О₂ → 2Н₂О + 2SO₂
H₂S горит голубоватым пламенем, а если над ним подержать перевернутый химический стакан, то на его стенках появится прозрачный конденсат (вода).
Однако при незначительном понижении температуры данная реакция проходит несколько иначе: на стенках предварительно охлажденного стакана появится уже желтоватый налет свободной серы:
2H₂S + О₂ → 2Н₂О + 2S
На этой реакции основан промышленный способ получения серы.
При поджигании предварительно подготовленной газообразной смеси сероводорода и кислорода происходит взрыв.
Реакция сероводорода и оксида серы(IV) также позволяет получить свободную серу:
2H₂S + SО₂ → 2Н₂О + 3S
Сероводород растворим в воде, причем три объема этого газа могут раствориться в одном объеме воды, образуя слабую и нестойкую сероводородную кислоту (Н₂S). Эту кислоту также называют сероводородной водой. Как видите, формулы газа-сероводорода и сероводородной кислоты записываются одинаково.
Если к сероводородной кислоте прилить раствор соли свинца, выпадет черный осадок сульфида свинца:
H₂S + Pb(NO₃)₂ → PbS + 2HNO₃
Это качественная реакция для обнаружения сероводорода. Она же демонстрирует способность сероводородной кислоты вступать в реакции обмена с растворами солей. Таким образом, любая растворимая соль свинца является реактивом на сероводород. Некоторые другие сульфиды металлов также имеют характерную окраску, например: сульфид цинка ZnS - белую, сульфид кадмия CdS - желтую, сульфид меди CuS - черную, сульфид сурьмы Sb₂S₃ - красную.
Кстати, сероводород является нестойким газом и при нагревании практически полностью разлагается на водород и свободную серу:
H₂S → Н₂ + S
Сероводород интенсивно взаимодействует с водными растворами галогенов:
H₂S + 4Cl₂ + 4H₂O→ H₂SO₄ + 8HCl
Сероводород в природе и жизнедеятельности человека
Сероводород входит в состав вулканических газов, природного газа и газов, сопутствующих месторождениям нефти. Много его и в природных минеральных водах, например, в Черном море он залегает на глубине от 150 метров и ниже.
Сероводород применяют :
- в медицине (лечение сероводородными ваннами и минеральными водами);
- в промышленности (получение серы, серной кислоты и сульфидов);
- в аналитической химии (для осаждения сульфидов тяжелых металлов, которые обычно нерастворимы);
- в органическом синтезе (для получения сернистых аналогов органических спиртов (меркаптанов) и тиофена (серосодержащего ароматического углеводорода). Еще одно из недавно появившихся направлений в науке - сероводородная энергетика. Всерьез изучается получение энергии из залежей сероводорода со дна Черного моря.
Природа окислительно-восстановительных реакций серы и водорода
Реакция образования сероводорода является окислительно-восстановительной:
Н₂⁰ + S⁰→ H₂⁺S²⁻
Процесс взаимодействия серы с водородом легко объясняется строением их атомов. Водород занимает первое место в периодической системе, следовательно, заряд его атомного ядра равен (+1), а вокруг ядра атома кружится 1 электрон. Водород с легкостью отдает свой электрон атомам других элементов, превращаясь в положительно заряженный ион водорода - протон:
Н⁰ -1е⁻= Н⁺
Сера находится на шестнадцатой позиции в таблице Менделеева. Значит, заряд ядра ее атома равен (+16), и количество электронов в каждом атоме также 16е⁻. Расположение серы в третьем периоде говорит о том, что ее шестнадцать электронов кружатся вокруг атомного ядра, образуя 3 слоя, на последнем из которых находится 6 валентных электронов. Количество валентных электронов серы соответствует номеру группы VI, в которой она находится в периодической системе.
Итак, сера может отдать все шесть валентных электронов, как в случае образования оксида серы(VI):
2S⁰ + 3O2⁰ → 2S⁺⁶O₃⁻²
Кроме того, в результате окисления серы, 4е⁻могут быть отданы ее атомом другому элементу с образованием оксида серы(IV):
S⁰ + О2⁰ → S⁺4 O2⁻²
Сера может отдать также два электрона c образованием хлорида серы(II) :
S⁰ + Cl2⁰ → S⁺² Cl2⁻
Во всех трех вышеуказанных реакциях сера отдает электроны. Следовательно, она окисляется, но при этом выступает в роли восстановителя для атомов кислорода О и хлора Cl. Однако в случае образования H2S окисление - удел атомов водорода, поскольку именно они теряют электроны, восстанавливая внешний энергетический уровень серы с шести электронов до восьми. В результате этого каждый атом водорода в его молекуле становится протоном:
Н2⁰-2е⁻ → 2Н⁺,
а молекула серы, наоборот, восстанавливаясь, превращается в отрицательно заряженный анион (S⁻²): S⁰ + 2е⁻ → S⁻²
Таким образом, в химической реакции образования сероводорода окислителем выступает именно сера.
С точки зрения проявления серой различных степеней окисления, интересно и еще одно взаимодействие оксида серы(IV) и сероводорода - реакция получения свободной серы:
2H₂⁺S-²+ S⁺⁴О₂-²→ 2H₂⁺O-²+ 3S⁰
Как видно из уравнения реакции, и окислителем, и восстановителем в ней являются ионы серы. Два аниона серы (2-) отдают по два своих электрона атому серы в молекуле оксида серы(II), в результате чего все три атома серы восстанавливаются до свободной серы.
2S-² - 4е⁻→ 2S⁰ - восстановитель, окисляется;
S⁺⁴ + 4е⁻→ S⁰ - окислитель, восстанавливается.
 Ударение в английском языке
Ударение в английском языке 10 слов с ударением на 1 слог
10 слов с ударением на 1 слог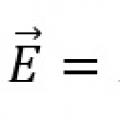 Закон Ома для замкнутой цепи и неоднородного участка цепи
Закон Ома для замкнутой цепи и неоднородного участка цепи