Химические элементы периодической системы. Периодическая система Менделеева. Химические элементы периодической системы Структура и правила размещения элементов
Как пользоваться таблицей Менделеева? Для непосвященного человека читать таблицу Менделеева – всё равно, что для гнома смотреть на древние руны эльфов. А таблица Менделеева может рассказать о мире очень многое.
Помимо того, что сослужит вам службу на экзамене, она еще и просто незаменима при решении огромного количества химических и физических задач. Но как ее читать? К счастью, сегодня этому искусству может научиться каждый. В этой статье расскажем, как понять таблицу Менделеева.
Периодическая система химических элементов (таблица Менделеева) – это классификация химических элементов, которая устанавливает зависимость различных свойств элементов от заряда атомного ядра.
История создания Таблицы
Дмитрий Иванович Менделеев был не простым химиком, если кто-то так думает. Это был химик, физик, геолог, метролог, эколог, экономист, нефтяник, воздухоплаватель, приборостроитель и педагог. За свою жизнь ученый успел провести фундаментально много исследований в самых разных областях знаний. Например, широко распространено мнение, что именно Менделеев вычислил идеальную крепость водки – 40 градусов.
Не знаем, как Менделеев относился к водке, но точно известно, что его диссертация на тему «Рассуждение о соединении спирта с водой» не имела к водке никакого отношения и рассматривала концентрации спирта от 70 градусов. При всех заслугах ученого, открытие периодического закона химических элементов – одного их фундаментальных законов природы, принесло ему самую широкую известность.

Существует легенда, согласно которой периодическая система приснилась ученому, после чего ему осталось лишь доработать явившуюся идею. Но, если бы все было так просто.. Данная версия о создании таблицы Менделеева, по-видимому, не более чем легенда. На вопрос о том, как была открыта таблица, сам Дмитрий Иванович отвечал: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово»
В середине девятнадцатого века попытки упорядочить известные химические элементы (известно было 63 элемента) параллельно предпринимались несколькими учеными. Например, в 1862 году Александр Эмиль Шанкуртуа разместил элементы вдоль винтовой линии и отметил циклическое повторение химических свойств.
Химик и музыкант Джон Александр Ньюлендс предложил свой вариант периодической таблицы в 1866 году. Интересен тот факт, что в расположении элементов ученый пытался обнаружить некую мистическую музыкальную гармонию. В числе прочих попыток была и попытка Менделеева, которая увенчалась успехом.

В 1869 году была опубликована первая схема таблицы, а день 1 марта 1869 года считается днем открытия периодического закона. Суть открытия Менделеева состояла в том, что свойства элементов с ростом атомной массы изменяются не монотонно, а периодически.
Первый вариант таблицы содержал всего 63 элемента, но Менделеев предпринял ряд очень нестандартных решений. Так, он догадался оставлять в таблице место для еще неоткрытых элементов, а также изменил атомные массы некоторых элементов. Принципиальная правильность закона, выведенного Менделеевым, подтвердилась очень скоро, после открытия галлия, скандия и германия, существование которых было предсказано ученым.
Современный вид таблицы Менделеева
Ниже приведем саму таблицу

Сегодня для упорядочения элементов вместо атомного веса (атомной массы) используется понятие атомного числа (числа протонов в ядре). В таблице содержится 120 элементов, которые расположены слева направо в порядке возрастания атомного числа (числа протонов)
Столбцы таблицы представляют собой так называемые группы, а строки – периоды. В таблице 18 групп и 8 периодов.
- Металлические свойства элементов при движении вдоль периода слева направо уменьшаются, а в обратном направлении – увеличиваются.
- Размеры атомов при перемещении слева направо вдоль периодов уменьшаются.
- При движении сверху вниз по группе увеличиваются восстановительные металлические свойства.
- Окислительные и неметаллические свойства при движении вдоль периода слева направо увеличиваются.
Что мы узнаем об элементе по таблице? Для примера, возьмем третий элемент в таблице – литий, и рассмотрим его подробно.

Первым делом мы видим сам символ элемента и его название под ним. В верхнем левом углу находится атомный номер элемента, в порядке которого элемент расположен в таблице. Атомный номер, как уже было сказано, равен числу протонов в ядре. Число положительных протонов, как правило, равно числу отрицательных электронов в атоме (за исключением изотопов).
Атомная масса указана под атомным числом (в данном варианте таблицы). Если округлить атомную массу до ближайшего целого, мы получим так называемое массовое число. Разность массового числа и атомного числа дает количество нейтронов в ядре. Так, число нейтронов в ядре гелия равно двум, а у лития – четырем.
Вот и закончился наш курс "Таблица Менделеева для чайников". В завершение, предлагаем вам посмотреть тематическое видео, и надеемся, что вопрос о том, как пользоваться периодической таблицей Менделеева, стал вам более понятен. Напоминаем, что изучать новый предмет всегда эффективнее не одному, а при помощи опытного наставника. Именно поэтому, никогда не стоит забывать о студенческом сервисе , который с радостью поделится с вами своими знаниями и опытом.
ЕСТЬ ЛИ ПРЕДЕЛ
ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ
Д.И.МЕНДЕЛЕЕВА?
ОТКРЫТИЕ НОВЫХ ЭЛЕМЕНТОВ
П роблема систематизации химических элементов привлекла к себе пристальное внимание в середине XIX в., когда стало ясно, что многообразие окружающих нас веществ является результатом разных сочетаний сравнительно малого числа химических элементов.
В хаосе элементов и их соединений великий русский химик Д.И.Менделеев первым навел порядок, создав свою периодическую таблицу элементов.
1 марта 1869 г. считается днем открытия периодического закона, когда Менделеев сообщил о нем научному сообществу. Известные в то время 63 элемента ученый разместил в своей таблице таким образом, что главные свойства этих элементов и их соединений менялись периодически по мере увеличения их атомной массы. Наблюдаемые изменения свойств элементов в горизонтальном и вертикальном направлениях таблицы следовали строгим правилам. Например, ярко выраженный у элементов Iа группы металлический (основный) характер с увеличением атомной массы убывал по горизонтали таблицы и возрастал по вертикали.
Опираясь на открытый закон, Менделеев предсказал свойства нескольких еще не открытых элементов и их место в периодической таблице. Уже в 1875 г. был открыт «экаалюминий» (галлий), еще через четыре года – «экабор» (скандий), а в 1886 г. – «экасилиций» (германий). В последующие годы таблица Менделеева служила и до сих пор служит ориентиром в поисках новых элементов и предвидении их свойств.
Однако ни сам Менделеев, ни его современники не могли ответить на вопрос, в чем причины периодичности свойств элементов, существует ли и где проходит граница периодической системы. Менделеев предчувствовал, что причина представленной им взаимосвязи между свойствами и атомной массой элементов кроется в сложности самих атомов.
Лишь спустя много лет после создания периодической системы химических элементов в работах Э.Резерфорда, Н.Бора и других ученых было доказано сложное строение атома. Последующие достижения атомной физики позволили решить многие неясные проблемы периодической системы химических элементов. Прежде всего оказалось, что место элемента в периодической таблице определяется не атомной массой, а зарядом ядра. Стала понятной природа периодичности химических свойств элементов и их соединений.
Атом стали рассматривать как систему, в центре которой находится положительно заряженное ядро, а вокруг него вращаются отрицательно заряженные электроны. При этом электроны группируются в околоядерном пространстве и движутся по определенным орбитам, входящим в электронные оболочки.
Все электроны атома принято обозначать с
помощью чисел и букв. Согласно этому обозначению
главные квантовые числа 1, 2, 3, 4, 5, 6, 7 относятся к
электронным оболочкам, а буквы s
, p
, d
, f
,
g
– к подоболочкам (орбитам) каждой оболочки.
Первая оболочка (считая от ядра) имеет только s
-электроны,
вторая может иметь s
- и p
- электроны, третья
– s
-, p
- и d
-электроны, четвертая – s
-,
p
-, d
- и f
- электроны и т.д.
Каждая оболочка может вместить вполне определенное число электронов: первая – 2, вторая – 8, третья – 18, четвертая и пятая – по 32. Этим определяется число элементов в периодах таблицы Менделеева. Химические свойства элементов обусловлены строением внешней и предвнешней электронных оболочек атомов, т.е. тем, сколько электронов они содержат.
Ядро атома состоит из положительно заряженных частиц – протонов и электрически нейтральных частиц – нейтронов, часто называемых одним словом – нуклоны. Порядковый номер элемента (его место в периодической таблице) определяется числом протонов в ядре атома данного элемента. Массовое число А атома элемента равно сумме чисел протонов Z и нейтронов N в ядре: A = Z + N . Атомы одного и того же элемента с разным числом нейтронов в ядре являются его изотопами.
Химические свойства разных изотопов одного и того же элемента не отличаются друг от друга, а ядерные – изменяются в широких пределах. Это проявляется прежде всего в стабильности (или нестабильности) изотопов, которая существенно зависит от соотношения числа протонов и нейтронов в ядре. Легкие стабильные изотопы элементов обычно характеризуются равным числом протонов и нейтронов. С ростом заряда ядра, т. е. порядкового номера элемента в таблице, это соотношение меняется. У стабильных тяжелых ядер нейтронов почти в полтора раза больше, чем протонов.
Как и атомные электроны, нуклоны также образуют оболочки. С увеличением числа частиц в ядре последовательно заполняются протонные и нейтронные оболочки. Ядра с полностью заполненными оболочками являются самыми стабильными. Например, очень устойчивой ядерной структурой характеризуется изотоп свинца Pb-208, который имеет заполненные оболочки протонов (Z = 82) и нейтронов (N = 126).
Подобные заполненные ядерные оболочки аналогичны заполненным электронным оболочкам атомов инертных газов, представляющих отдельную группу в периодической таблице. Стабильные ядра атомов с полностью заполненными протонными или нейтронными оболочками содержат определенные «магические» числа протонов или нейтронов: 2, 8, 20, 28, 50, 82, 114, 126, 184. Таким образом, атомам элементов в целом, как и по химическим свойствам, присуща также периодичность и ядерных свойств. Среди разных сочетаний числа протонов и нейтронов в ядрах изотопов (четно-четных; четно-нечетных; нечетно-четных; нечетно-нечетных) именно ядра, содержащие четное число протонов и четное число нейтронов, отличаются наибольшей устойчивостью.
Природа сил, удерживающих в ядре протоны и нейтроны, пока недостаточно ясна. Полагают, что между нуклонами действуют очень большие гравитационные силы притяжения, которые способствуют увеличению стабильности ядер.
К середине тридцатых годов прошлого столетия периодическая таблица была разработана настолько, что показывала положение уже 92 элементов. Под порядковым номером 92 был уран – последний из найденных на Земле еще в 1789 г. естественных тяжелых элементов. Из 92 элементов таблицы только элементы с порядковыми номерами 43, 61, 85 и 87 в тридцатые годы не были точно установлены. Они были открыты и изучены позже. Редкоземельный элемент с атомным номером 61 – прометий – был обнаружен в малых количествах в рудах как продукт самопроизвольного распада урана. Анализ атомных ядер недостающих элементов показал, что все они радиоактивны, причем из-за коротких периодов их полураспада они не могут существовать на Земле в заметных концентрациях.
В связи с тем, что последним тяжелым элементом, найденным на Земле, был элемент с атомным номером 92, можно было бы предположить, что он и является естественным пределом периодической таблицы Менделеева. Однако достижения атомной физики указали путь, по которому оказалось возможным перешагнуть через поставленную природой границу периодической таблицы.
Элементы с бо льшими атомными номерами, чем у урана, называют трансурановыми. По своему происхождению эти элементы являются искусственными (синтетическими). Их получают путем ядерных реакций трансформации элементов, встречающихся в природе.
Первую попытку, хотя не совсем удачную, открыть трансурановую область периодической системы предпринял итальянский физик Энрико Ферми в Риме вскоре после того, как было доказано существование нейтронов. Но лишь в 1940–1941 гг. успеха в открытии первых двух трансурановых элементов, а именно нептуния (атомный номер 93) и плутония (атомный номер 94), добились американские ученые из Калифорнийского университета в Беркли.
В основе методов получения трансурановых элементов лежит несколько видов ядерных реакций.
Первый вид – нейтронный синтез. В этом методе в ядрах тяжелых атомов, облученных нейтронами, происходит превращение одного из нейтронов в протон. Реакция сопровождается так называемым электронным распадом ( – -распадом) – образованием и выбросом из ядра с огромной кинетической энергией отрицательно заряженной – -частицы (электрона). Реакция возможна при избытке в ядре нейтронов.
Противоположной реакцией является превращение протона в нейтрон с испусканием положительно заряженной + -частицы (позитрона). Подобный позитронный распад ( + -распад) наблюдается при недостатке в ядрах нейтронов и ведет к уменьшению заряда ядра, т.е. к уменьшению атомного номера элемента на единицу. Аналогичный эффект достигается, когда протон превращается в нейтрон за счет захвата ближайшего орбитального электрона.
Новые трансурановые элементы вначале были получены из урана по методу нейтронного синтеза в ядерных реакторах (как продукты взрыва ядерных бомб), а позже синтезированы с помощью ускорителей частиц – циклотронов.
Второй вид – реакции между ядрами атомов исходного элемента («мишени») и ядрами атомов легких элементов (изотопов водорода, гелия, азота, кислорода и других), используемых в качестве бомбардирующих частиц. Протоны в ядрах «мишени» и «снаряда» имеют положительный электрический заряд и испытывают сильное отталкивание при приближении друг к другу. Чтобы преодолеть силы отталкивания, образовать составное ядро, необходимо обеспечить атомы «снаряда» очень большой кинетической энергией. Такой огромной энергией бомбардирующие частицы запасаются в циклотронах. Образовавшееся промежуточное составное ядро обладает довольно большой избыточной энергией, которая должна быть высвобождена для стабилизации нового ядра. В случае тяжелых трансурановых элементов эта избыточная энергия, когда не происходит деления ядер, рассеивается путем испускания -лучей (высокоэнергетического электромагнитного излучения) и «испарения» нейтронов из возбужденных ядер. Ядра атомов нового элемента являются радиоактивными. Они стремятся достигнуть более высокой устойчивости путем изменения внутреннего строения через радиоактивный электронный – -распад либо -распад и самопроизвольное деление. Такие ядерные реакции присущи наиболее тяжелым атомам элементов с порядковыми номерами выше 98.
Реакция спонтанного, самопроизвольного деления ядер атомов радиоактивных элементов была открыта нашим соотечественником Г.Н.Флеровым и чехом К.А.Петржаком в Объединенном институте ядерных исследований (ОИЯИ, г. Дубна) в опытах с ураном-238. Увеличение порядкового номера приводит к быстрому уменьшению времени полураспада ядер атомов радиоактивных элементов.
В связи с этим фактом выдающийся американский ученый Г.Т.Сиборг, лауреат Нобелевской премии, участвовавший в открытии девяти трансурановых элементов, полагал, что открытие новых элементов, вероятно, закончится приблизительно на элементе с порядковым номером 110 (по свойствам аналогичном платине). Эта мысль о границе периодической таблицы была высказана в 60-е годы прошлого столетия с оговоркой: если не будут открыты новые методы синтеза элементов и существование пока неизвестных областей устойчивости самых тяжелых элементов. Некоторые из таких возможностей были выявлены.
Третий вид ядерных реакций синтеза новых элементов – реакции между высокоэнергетическими ионами со средней атомной массой (кальция, титана, хрома, никеля) в качестве бомбардирующих частиц и атомами стабильных элементов (свинца, висмута) в качестве «мишени» вместо тяжелых радиоактивных изотопов. Этот путь получения более тяжелых элементов был предложен в 1973 г. нашим ученым Ю.Ц.Оганесяном из ОИЯИ и успешно использован в других странах. Главное достоинство предложенного метода синтеза заключалось в образовании менее «горячих» составных ядер при слиянии ядер «снаряда» и «мишени». Высвобождение избыточной энергии составных ядер в этом случае происходило в результате «испарения» существенно меньшего числа нейтронов (одного или двух вместо четырех или пяти).
Необычная ядерная реакция между ионами редкого
изотопа Са-48, ускоренными в циклотроне
У-400, и атомами актиноидного элемента кюрия Cm-248 с
образованием элемента-114 («экасвинца») была
открыта в Дубне в 1979 г. Было установлено, что в
этой реакции образуется «холодное» ядро, не
«испаряющее» ни одного нейтрона, а всю
избыточную энергию уносит одна -частица. Это означает, что для
синтеза новых элементов может быть реализован
также четвертый вид
ядерных реакций между
ускоренными ионами атомов со средними массовыми
числами и атомами тяжелых трансурановых
элементов.
В развитии теории периодической системы химических элементов большую роль сыграло сопоставление химических свойств и строения электронных оболочек лантаноидов с порядковыми номерами 58–71 и актиноидов с порядковыми номерами 90–103. Было показано, что сходство химических свойств лантаноидов и актиноидов обусловлено подобием их электронных структур. Обе группы элементов являются примером внутреннего переходного ряда с последовательным заполнением 4f - или 5f -электронных оболочек соответственно после заполнения внешних s - и р -электронных орбиталей.
Элементы с порядковыми номерами в периодической таблице 110 и выше были названы сверхтяжелыми. Продвижение к открытию этих элементов становится все более трудным и долгим, т.к. недостаточно провести синтез нового элемента, нужно его идентифицировать и доказать, что новый элемент обладает лишь ему одному присущими свойствами. Трудности вызваны тем, что для изучения свойств новых элементов доступным оказывается небольшое число атомов. Время же, в течение которого можно изучать новый элемент до того, как произойдет радиоактивный распад, обычно очень невелико. В этих случаях, даже когда получен всего один атом нового элемента, для его обнаружения и предварительного изучения некоторых характеристик используют метод радиоактивных индикаторов.
Элемент-109 – мейтнерий – это последний элемент в периодической таблице, представленной в большинстве учебников по химии. Элемент-110, принадлежащий к той же группе периодической таблицы, что и платина, был впервые синтезирован в г. Дармштадт (Германия) в 1994 г. с помощью мощного ускорителя тяжелых ионов по реакции:
![]()
Время полураспада полученного изотопа крайне мало. В августе 2003 г. 42-я Генеральная ассамблея ИЮПАК и Совет ИЮПАК (Международный союз по чистой и прикладной химии) официально утвердили название и символ элемента-110: дармштадтий, Ds.
Там же, в Дармштадте, в 1994 г. впервые был получен элемент-111 путем воздействия пучка ионов изотопа 64 28 Ni на атомы 209 83 Bi в качестве «мишени». Своим решением в 2004 г. ИЮПАК признал открытие и одобрил предложение назвать элемент-111 рентгением, Rg, в честь выдающегося немецкого физика В.К.Рентгена, открывшего Х -лучи, которым он дал такое название из-за неопределенности их природы.
По информации, полученной из ОИЯИ, в Лаборатории ядерных реакций им. Г.Н.Флерова осуществлен синтез элементов с порядковыми номерами 110–118 (за исключением элемента-117).
В результате синтеза по реакции:
![]()
в Дармштадте в 1996 г. получено несколько атомов нового элемента-112, распадающегося с выделением -частиц. Период полураспада этого изотопа составлял всего 240 микросекунд. Немного позже в ОИЯИ поиск новых изотопов элемента-112 провели, облучая атомы U-235 ионами Са-48.
В феврале 2004 г. в престижных научных журналах появились сообщения об открытии в ОИЯИ нашими учеными совместно с американскими исследователями из Национальной лаборатории имени Лоуренса в Беркли (США) двух новых элементов с номерами 115 и 113. Этой группой ученых в экспериментах, проведенных в июле–августе 2003 г. на циклотроне У-400 с газонаполненным сепаратором, в реакции между атомами Am-243 и ионами изотопа Ca-48 были синтезированы 1 атом изотопа элемента-115 с массовым числом 287 и 3 атома с массовым числом 288. Все четыре атома элемента-115 быстро распадались с выделением -частиц и образованием изотопов элемента-113 с массовыми числами 282 и 284. Наиболее стабильный изотоп 284 113 имел период полураспада около 0,48 с. Он разрушался с эмиссией -частиц и превращался в изотоп рентгения 280 Rg.
В сентябре 2004 г. группа японских ученых из Физико-химического исследовательского института под руководством Косуки Морита (Kosuke Morita) заявила, что ими синтезирован элемент-113 по реакции:
При его распаде с выделением -частиц получен изотоп рентгения 274 Rg. Поскольку это первый искусственный элемент, полученный японскими учеными, они посчитали, что вправе сделать предложение назвать его «японием».
Выше уже отмечался необычный синтез изотопа элемента-114 с массовым числом 288 из кюрия. В 1999 г. появилось сообщение о получении в ОИЯИ этого же изотопа элемента-114 путем бомбардировки ионами Са-48 атомов плутония с массовым числом 244.
Было также заявлено об открытии элементов с порядковыми номерами 118 и 116 в результате длительных совместных исследований ядерных реакций изотопов калифорния Cf-249 и кюрия Сm-245 c пучком тяжелых ионов Са-48, проведенных российскими и американскими учеными в период 2002–2005 гг. в ОИЯИ. Элемент-118 замыкает 7-й период таблицы Менделеева, по своим свойствам является аналогом благородного газа радона. Элемент-116 должен обладать некоторыми свойствами, общими с полонием.
По сложившейся традиции открытие новых химических элементов и их идентификация должны быть подтверждены решением ИЮПАК, но право предложить названия элементам предоставляется первооткрывателям. Подобно карте Земли, периодическая таблица отразила названия территорий, стран, городов и научных центров, где были открыты и изучены элементы и их соединения, увековечила имена знаменитых ученых, внесших большой вклад в развитие периодической системы химических элементов. И не случайно элемент-101 назван именем Д.И.Менделеева.
Для ответа на вопрос, где может проходить граница периодической таблицы, в свое время была проведена оценка электростатических сил притяжения внутренних электронов атомов к положительно заряженному ядру. Чем больше порядковый номер элемента, тем сильнее сжимается электронная «шуба» вокруг ядра, тем сильнее притягиваются внутренние электроны к ядру. Должен наступить такой момент, когда электроны начнут захватываться ядром. В результате такого захвата и уменьшения заряда ядра существование очень тяжелых элементов становится невозможным. Подобная катастрофическая ситуация должна возникнуть при порядковом номере элемента, равном 170–180.
Эта гипотеза была опровергнута и показано, что нет ограничений для существования очень тяжелых элементов с точки зрения представлений о строении электронных оболочек. Ограничения возникают в результате неустойчивости самих ядер.
Однако надо сказать, что время жизни элементов уменьшается нерегулярно с ростом атомного номера. Следующая ожидаемая область устойчивости сверхтяжелых элементов, обусловленная появлением замкнутых нейтронных или протонных оболочек ядра, должна лежать в окрестности дважды магического ядра с 164 протонами и 308 нейтронами. Возможности открытия таких элементов пока не ясны.
Таким образом, вопрос о границе периодической таблицы элементов по-прежнему сохраняется. Исходя из правил заполнения электронных оболочек с увеличением атомного номера элемента, прогнозируемый 8-й период таблицы Менделеева должен содержать суперактиноидные элементы. Отводимое им место в периодической таблице Д.И.Менделеева соответствует III группе элементов, подобно уже известным редкоземельным и актиноидным трансурановым элементам.
Девятнадцатый век в истории человечества - век, в который многие науки реформировались, в том числе и химия. Именно в это время появилась периодическая система Менделеева, а вместе с ней - и периодический закон. Именно он стал основой современной химии. Периодическая система Д. И. Менделеева представляет собой систематизацию элементов, которая устанавливает зависимость химических и физических свойств от строения и заряда атома вещества.
История
Начало периодической положила книга «Соотношение свойств с атомным весом элементов», написанная в третьей четверти XVII века. В ней были отображены основные понятия относительно известных химических элементов (на тот момент их насчитывалось всего 63). К тому же у многих из них атомные массы были определены неправильно. Это сильно мешало открытию Д. И. Менделеева.
Дмитрий Иванович начал свою работу со сравнения свойств элементов. В первую очередь он занялся хлором и калием, а уж потом перешёл к работе со щелочными металлами. Вооружась специальными карточками, на которых были изображены химические элементы, он многократно пытался собрать эту «мозаику»: раскладывал на своем столе в поисках нужных комбинаций и совпадений.
После долгих стараний Дмитрий Иванович все же нашёл ту закономерность, которую искал, и выстроил элементы в периодические ряды. Получив в результате пустые ячейки между элементами, учёный понял, что русским исследователям известны не все химические элементы, и что именно он должен дать этому миру те знания в области химии, которые ещё не были даны его предшественниками.

Всем известен миф о том, что Менделееву периодическая таблица явилась во сне, и он по памяти собрал элементы в единую систему. Это, грубо говоря, ложь. Дело в том, что Дмитрий Иванович довольно долго и сосредоточенно работал над своим трудом, и его это сильно выматывало. Во время работы над системой элементов Менделеев однажды заснул. Проснувшись, он понял, что не закончил таблицу, и скорее продолжил заполнение пустых ячеек. Его знакомый, некий Иностранцев, университетский педагог, решил, что таблица Менделееву приснилась во сне и распространил данный слух среди своих студентов. Так и появилась данная гипотеза.
Известность
Химических элементов Менделеева является отображением созданного Дмитрием Ивановичем ещё в третьей четверти XIX века (1869 год) периодического закона. Именно в 1869 году на заседании русского химического сообщества было зачитано уведомление Менделеева о создании им определённой структуры. И в этом же году была выпущена книга «Основы химии», в которой впервые была опубликована периодическая система химических элементов Менделеева. А в книге «Естественная система элементов и использование её к указанию качеств неоткрытых элементов» Д. И. Менделеев впервые упомянул понятие «периодический закон».

Структура и правила размещения элементов
Первые шаги в создании периодического закона были сделаны Дмитрием Ивановичем еще в 1869-1871 годах, в то время он усиленно работал над установлением зависимости свойств данных элементов от массы их атома. Современный вариант представляет собой сведённые в двумерную таблицу элементы.
Положение элемента в таблице несёт определённый химический и физический смысл. По местонахождению элемента в таблице можно узнать, какая у него валентность, определить и другие химические особенности. Дмитрий Иванович пытался установить связь между элементами, как сходными между собой по свойствам, так и отличающимися.

В основу классификации известных на тот момент химических элементов он положил валентность и атомную массу. Сопоставляя относительные свойства элементов, Менделеев пытался найти закономерность, которая объединила бы все известные химические элементы в одну систему. Расположив их, основываясь на возрастании атомных масс, он всё-таки добился периодичности в каждом из рядов.
Дальнейшее развитие системы
Появившаяся в 1969 году таблица Менделеева ещё не раз дорабатывалась. С появлением благородных газов в 1930 годах получилось выявить новейшую зависимость элементов - не от массы, а от порядкового номера. Позднее удалось установить число протонов в атомных ядрах, и оказалось, что оно совпадает с порядковым номером элемента. Учёными XX века было изучено электронное Оказалось, что и оно влияет на периодичность. Это сильно меняло представления о свойствах элементов. Данный пункт был отражён в более поздних редакциях периодической системы Менделеева. Каждое новое открытие свойств и особенностей элементов органично вписывалось в таблицу.
Характеристики периодической системы Менделеева
Таблица Менделеева поделена на периоды (7 строк, расположенных горизонтально), которые, в свою очередь, подразделяются на большие и малые. Начинается период со щелочного металла, а заканчивается элементом с неметаллическими свойствами.
Вертикально таблица Дмитрия Ивановича поделена на группы (8 столбцов). Каждая из них в периодической системе состоит из двух подгрупп, а именно - главной и побочной. После долгих споров по предложению Д. И. Менделеева и его коллеги У. Рамзая было решено ввести так называемую нулевую группу. В неё входят инертные газы (неон, гелий, аргон, радон, ксенон, криптон). В 1911 году учёным Ф. Содди было предложено поместить в периодической системе и неразличимые элементы, так называемые изотопы, - для них были выделены отдельные ячейки.

Несмотря на верность и точность периодической системы, научное общество долго не хотело признавать данное открытие. Многие великие учёные высмеивали деятельность Д. И. Менделеева и считали, что невозможно предсказать свойства элемента, который ещё не был открыт. Но после того как предполагаемые химические элементы были открыты (а это были, например, скандий, галлий и германий), система Менделеева и его периодический закон стали науки химии.
Таблица в современности
Периодическая система элементов Менделеева - основа большинства химических и физических открытий, связанных с атомно-молекулярным учением. Современное понятие элемента сложилось как раз благодаря великому учёному. Появление периодической системы Менделеева внесло кардинальные изменения в представления о различных соединениях и простых веществах. Создание ученым периодической системы оказало огромное влияние на развитие химии и всех наук, смежных с ней.
В природе существует очень много повторяющихся последовательностей:
- времена года;
- время суток;
- дни недели…
В середине 19 века Д.И.Менделеев заметил, что химические свойства элементов также имеют определенную последовательность (говорят, что эта идея пришла ему во сне). Итогом чудесных сновидений ученого стала Периодическая таблица химических элементов, в которой Д.И. Менделеев выстроил химические элементы по возрастанию атомной массы. В современной таблице химические элементы выстроены по возрастанию атомного номера элемента (количество протонов в ядре атома).
Атомный номер изображен над символом химического элемента, под символом - его атомная масса (сумма протонов и нейтронов). Обратите внимание, что атомная масса у некоторых элементов является нецелым числом! Помните об изотопах! Атомная масса - это средневзвешенное от всех изотопов элемента, встречающихся в природе в естественных условиях.

Под таблицей расположены лантаноиды и актиноиды.
Металлы, неметаллы, металлоиды

Расположены в Периодической таблице слева от ступенчатой диагональной линии, которая начинается с Бора (В) и заканчивается полонием (Po) (исключение составляют германий (Ge) и сурьма (Sb). Нетрудно заметить, что металлы занимают бОльшую часть Периодической таблицы. Основные свойства металлов: твердые (кроме ртути); блестят; хорошие электро- и теплопроводники; пластичные; ковкие; легко отдают электроны.

Элементы, расположенные справа от ступенчатой диагонали B-Po, называются неметаллами . Свойства неметаллов прямо противоположны свойствам металлов: плохие проводники тепла и электричества; хрупкие; нековкие; непластичные; обычно принимают электроны.
Металлоиды
Между металлами и неметаллами находятся полуметаллы (металлоиды). Для них характерны свойства как металлов, так и неметаллов. Основное применение в промышленности полуметаллы нашли в производстве полупроводников, без которых немыслима ни одна современная микросхема или микропроцессор.
Периоды и группы
Как уже говорилось выше, периодическая таблица состоит из семи периодов. В каждом периоде атомные номера элементов увеличиваются слева направо.
Свойства элементов в периодах изменяются последовательно: так натрий (Na) и магний (Mg), находящиеся в начале третьего периода, отдают электроны (Na отдает один электрон: 1s 2 2s 2 2p 6 3s 1 ; Mg отдает два электрона: 1s 2 2s 2 2p 6 3s 2). А вот хлор (Cl), расположенный в конце периода, принимает один элемент: 1s 2 2s 2 2p 6 3s 2 3p 5 .
В группах же, наоборот, все элементы обладают одинаковыми свойствами. Например, в группе IA(1) все элементы, начиная с лития (Li) и заканчивая францием (Fr), отдают один электрон. А все элементы группы VIIA(17), принимают один элемент.
Некоторые группы настолько важны, что получили особые названия. Эти группы рассмотрены ниже.
Группа IA(1) . Атомы элементов этой группы имеют во внешнем электронном слое всего по одному электрону, поэтому легко отдают один электрон.
Наиболее важные щелочные металлы - натрий (Na) и калий (K), поскольку играют важную роль в процессе жизнедеятельности человека и входят в состав солей.
Электронные конфигурации:
- Li - 1s 2 2s 1 ;
- Na - 1s 2 2s 2 2p 6 3s 1 ;
- K - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1
Группа IIA(2) . Атомы элементов этой группы имеют во внешнем электронном слое по два электрона, которые также отдают во время химических реакций. Наиболее важный элемент - кальций (Ca) - основа костей и зубов.
Электронные конфигурации:
- Be - 1s 2 2s 2 ;
- Mg - 1s 2 2s 2 2p 6 3s 2 ;
- Ca - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2
Группа VIIA(17) . Атомы элементов этой группы обычно получают по одному электрону, т.к. на внешнем электронном слое находится по пять элементов и до "полного комплекта" как раз не хватает одного электрона.
Наиболее известные элементы этой группы: хлор (Cl) - входит в состав соли и хлорной извести; йод (I) - элемент, играющий важную роль в деятельности щитовидной железы человека.
Электронная конфигурация:
- F - 1s 2 2s 2 2p 5 ;
- Cl - 1s 2 2s 2 2p 6 3s 2 3p 5 ;
- Br - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 5
Группа VIII(18). Атомы элементов этой группы имеют полностью "укомплектованный" внешний электронный слой. Поэтому им "не надо" принимать электроны. И отдавать их они "не хотят". Отсюда - элементы этой группы очень "неохотно" вступают в химические реакции. Долгое время считалось, что они вообще не вступают в реакции (отсюда и название "инертный", т.е. "бездействующий"). Но химик Нейл Барлетт открыл, что некоторые из этих газов при определенных условиях все же могут вступать в реакции с другими элементами.
Электронные конфигурации:
- Ne - 1s 2 2s 2 2p 6 ;
- Ar - 1s 2 2s 2 2p 6 3s 2 3p 6 ;
- Kr - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6
Валентные элементы в группах
Нетрудно заметить, что внутри каждой группы элементы похожи друг на друга своими валентными электронами (электроны s и p-орбиталей, расположенных на внешнем энергетическом уровне).
У щелочных металлов - по 1 валентному электрону:
- Li - 1s 2 2s 1 ;
- Na - 1s 2 2s 2 2p 6 3s 1 ;
- K - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1
У щелочноземельных металлов - по 2 валентных электрона:
- Be - 1s 2 2s 2 ;
- Mg - 1s 2 2s 2 2p 6 3s 2 ;
- Ca - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2
У галогенов - по 7 валентных электронов:
- F - 1s 2 2s 2 2p 5 ;
- Cl - 1s 2 2s 2 2p 6 3s 2 3p 5 ;
- Br - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 5
У инертных газов - по 8 валентных электронов:
- Ne - 1s 2 2s 2 2p 6 ;
- Ar - 1s 2 2s 2 2p 6 3s 2 3p 6 ;
- Kr - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6
Дополнительную информацию см. в статье Валентность и в Таблице электронных конфигураций атомов химических элементов по периодам .
Обратим теперь свое внимание на элементы, расположенные в группах с символов В . Они расположены в центре периодической таблицы и называются переходными металлами .
Отличительной особенностью этих элементов является присутствие в атомах электронов, заполняющих d-орбитали :
- Sc - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1 ;
- Ti - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2
Отдельно от основной таблицы расположены лантаноиды и актиноиды - это, так называемые, внутренние переходные металлы . В атомах этих элементов электроны заполняют f-орбитали :
- Ce - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 4d 10 5s 2 5p 6 4f 1 5d 1 6s 2 ;
- Th - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 4d 10 5s 2 5p 6 4f 14 5d 10 6s 2 6p 6 6d 2 7s 2
Бесс Руфф - аспирантка Университета штата Флорида, работает над получением степени PhD по географии. Получила степень магистра экологии и менеджмента в Калифорнийском университете в Санта-Барбаре в 2016 году. Проводила исследования для проектов по морскому пространственному планированию в Карибском море и обеспечивала научную поддержке в качестве дипломированного участника Группы устойчивого рыболовства.
Количество источников, использованных в этой статье: . Вы найдете их список внизу страницы.
Если таблица Менделеева кажется вам сложной для понимания, вы не одиноки! Хотя бывает непросто понять ее принципы, умение работать с ней поможет при изучении естественных наук. Для начала изучите структуру таблицы и то, какую информацию можно узнать из нее о каждом химическом элементе. Затем можно приступить к изучению свойств каждого элемента. И наконец, с помощью таблицы Менделеева можно определить число нейтронов в атоме того или иного химического элемента.
Шаги
Часть 1
Структура таблицы-
Как видно, каждый следующий элемент содержит на один протон больше, чем предшествующий ему элемент. Это очевидно, если посмотреть на атомные номера. Атомные номера возрастают на один при движении слева направо. Поскольку элементы расположены по группам, некоторые ячейки таблицы остаются пустыми.
- Например, первая строка таблицы содержит водород, который имеет атомный номер 1, и гелий с атомным номером 2. Однако они расположены на противоположных краях, так как принадлежат к разным группам.
-
Узнайте о группах, которые включают в себя элементы со схожими физическими и химическими свойствами. Элементы каждой группы располагаются в соответствующей вертикальной колонке. Как правило, они обозначаются одним цветом, что помогает определить элементы со схожими физическими и химическими свойствами и предсказать их поведение. Все элементы той или иной группы имеют одинаковое число электронов на внешней оболочке.
- Водород можно отнести как к группе щелочных металлов, так и к группе галогенов. В некоторых таблицах его указывают в обеих группах.
- В большинстве случаев группы пронумерованы от 1 до 18, и номера ставятся вверху или внизу таблицы. Номера могут быть указаны римскими (например, IA) или арабскими (например,1A или 1) цифрами.
- При движении вдоль колонки сверху вниз говорят, что вы «просматриваете группу».
-
Узнайте, почему в таблице присутствуют пустые ячейки. Элементы упорядочены не только в соответствии с их атомным номером, но и по группам (элементы одной группы обладают схожими физическими и химическими свойствами). Благодаря этому можно легче понять, как ведет себя тот или иной элемент. Однако с ростом атомного номера не всегда находятся элементы, которые попадают в соответствующую группу, поэтому в таблице встречаются пустые ячейки.
- Например, первые 3 строки имеют пустые ячейки, поскольку переходные металлы встречаются лишь с атомного номера 21.
- Элементы с атомными номерами с 57 по 102 относятся к редкоземельным элементам, и обычно их выносят в отдельную подгруппу в нижнем правом углу таблицы.
-
Каждая строка таблицы представляет собой период. Все элементы одного периода имеют одинаковое число атомных орбиталей, на которых расположены электроны в атомах. Количество орбиталей соответствует номеру периода. Таблица содержит 7 строк, то есть 7 периодов.
- Например, атомы элементов первого периода имеют одну орбиталь, а атомы элементов седьмого периода - 7 орбиталей.
- Как правило, периоды обозначаются цифрами от 1 до 7 слева таблицы.
- При движении вдоль строки слева направо говорят, что вы «просматриваете период».
-
Научитесь различать металлы, металлоиды и неметаллы. Вы лучше будете понимать свойства того или иного элемента, если сможете определить, к какому типу он относится. Для удобства в большинстве таблиц металлы, металлоиды и неметаллы обозначаются разными цветами. Металлы находятся в левой, а неметаллы - в правой части таблицы. Металлоиды расположены между ними.
Часть 2
Обозначения элементов-
Каждый элемент обозначается одной или двумя латинскими буквами. Как правило, символ элемента приведен крупными буквами в центре соответствующей ячейки. Символ представляет собой сокращенное название элемента, которое совпадает в большинстве языков. При проведении экспериментов и работе с химическими уравнениями обычно используются символы элементов, поэтому полезно помнить их.
- Обычно символы элементов являются сокращением их латинского названия, хотя для некоторых, особенно недавно открытых элементов, они получены из общепринятого названия. К примеру, гелий обозначается символом He, что близко к общепринятому названию в большинстве языков. В то же время железо обозначается как Fe, что является сокращением его латинского названия.
-
Обратите внимание на полное название элемента, если оно приведено в таблице. Это «имя» элемента используется в обычных текстах. Например, «гелий» и «углерод» являются названиями элементов. Обычно, хотя и не всегда, полные названия элементов указываются под их химическим символом.
- Иногда в таблице не указываются названия элементов и приводятся лишь их химические символы.
-
Найдите атомный номер. Обычно атомный номер элемента расположен вверху соответствующей ячейки, посередине или в углу. Он может также находиться под символом или названием элемента. Элементы имеют атомные номера от 1 до 118.
- Атомный номер всегда является целым числом.
-
Помните о том, что атомный номер соответствует числу протонов в атоме. Все атомы того или иного элемента содержат одинаковое количество протонов. В отличие от электронов, количество протонов в атомах элемента остается постоянным. В противном случае получился бы другой химический элемент!
- По атомному номеру элемента можно также определить количество электронов и нейтронов в атоме.
-
Обычно количество электронов равно числу протонов. Исключением является тот случай, когда атом ионизирован. Протоны имеют положительный, а электроны - отрицательный заряд. Поскольку атомы обычно нейтральны, они содержат одинаковое количество электронов и протонов. Тем не менее, атом может захватывать электроны или терять их, и в этом случае он ионизируется.
- Ионы имеют электрический заряд. Если в ионе больше протонов, то он обладает положительным зарядом, и в этом случае после символа элемента ставится знак «плюс». Если ион содержит больше электронов, он имеет отрицательный заряд, что обозначается знаком «минус».
- Знаки «плюс» и «минус» не ставятся, если атом не является ионом.
-
Таблица Менделеева, или периодическая система химических элементов, начинается в левом верхнем углу и заканчивается в конце последней строки таблицы (в нижнем правом углу). Элементы в таблице расположены слева направо в порядке возрастания их атомного номера. Атомный номер показывает, сколько протонов содержится в одном атоме. Кроме того, с увеличением атомного номера возрастает и атомная масса. Таким образом, по расположению того или иного элемента в таблице Менделеева можно определить его атомную массу.
 10 слов с ударением на 1 слог
10 слов с ударением на 1 слог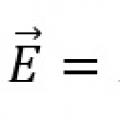 Закон Ома для замкнутой цепи и неоднородного участка цепи
Закон Ома для замкнутой цепи и неоднородного участка цепи Чиновники-академики уволены с госслужбы
Чиновники-академики уволены с госслужбы