H2so4 описание. Формула серной кислоты структурная химическая. Реакции с солями
Неразбавленная серная кислота представляет собой ковалентное соединение.
В молекуле серная кислота тетраэдрически окружена четырьмя атомами кислорода, два из которых входят в состав гидроксильных групп. Связи S – O – двойные, а S – OH – одинарные.
Бесцветные, похожие на лед кристаллы имеют слоистую структуру: каждая молекула H 2 SO 4 соединена с четырьмя соседними прочными водородными связями, образуя единый пространственный каркас.

Структура жидкой серной кислоты похожа на структуру твердой, только целостность пространственного каркаса нарушена.
Физические свойства серной кислоты
При обычных условиях серная кислота – тяжёлая маслянистая жидкость без цвета и запаха. В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом. Если молярное отношение SO 3: Н 2 О меньше 1, то это водный раствор серной кислоты, если больше 1, – раствор SO 3 в серной кислоте.
100 %-ная H 2 SO 4 кристаллизуется при 10,45 °С; Т кип = 296,2 °С; плотность 1,98 г/см 3 . H 2 SO 4 смешивается с Н 2 О и SO 3 в любых соотношениях с образованием гидратов, теплота гидратации настолько велика, что смесь может вскипать, разбрызгиваться и вызывать ожоги. Поэтому необходимо добавлять кислоту к воде, а не наоборот, поскольку при добавлении воды к кислоте более легкая вода окажется на поверхности кислоты, где и сосредоточится вся выделяющаяся теплота.
При нагревании и кипении водных растворов серной кислоты, содержащих до 70 % H 2 SO 4 , в паровую фазу выделяются только пары воды. Над более концентрированными растворами появляются и пары серной кислоты.
По структурным особенностям и аномалиям жидкая серная кислота похожа на воду. Здесь та же система водородных связей, почти такой же пространственный каркас.
Химические свойства серной кислоты
Серная кислота – одна из самых сильных минеральных кислот, из-за высокой полярности связь Н – О легко разрывается.
В водном растворе серная кислота диссоциирует , образуя ион водорода и кислотный остаток:
H 2 SO 4 = H + + HSO 4 - ;
HSO 4 - = H + + SO 4 2- .
Суммарное уравнение:
H 2 SO 4 = 2H + + SO 4 2- .
Проявляет свойства кислот , реагирует с металлами, оксидами металлов, основаниями и солями.
Разбавленная серная кислота не проявляет окислительных свойств, при ее взаимодействии с металлами выделяется водород и соль, содержащая металл в низшей степени окисления. На холоде кислота инертна по отношению к таким металлам, как железо, алюминий и даже барий.
Концентрированная кислота обладает окислительными свойствами. Возможные продукты взаимодействия простых веществ с концентрированной серной кислотой приведены в таблице. Показана зависимость продукта восстановления от концентрации кислоты и степени активности металла: чем активнее металл, тем глубже он восстанавливает сульфат-ион серной кислоты.

Взаимодействие с оксидами:
CaO + H 2 SO 4 = CaSO 4 = H 2 O.
Взаимодействие с основаниями:
2NaOH + H 2 SO 4 = Na 2 SO 4 + 2H 2 O.
Взаимодействие с солями:
Na 2 CO 3 + H 2 SO 4 = Na 2 SO 4 + CO 2 + H 2 O.
Окислительные свойства
Серная кислота окисляет HI и НВг до свободных галогенов:
H 2 SO 4 + 2HI = I 2 + 2H 2 O + SO 2.
Серная кислота отнимает химически связанную воду от органических соединений, содержащих гидроксильные группы. Дегидратация этилового спирта в присутствии концентрированной серной кислоты приводит к получению этилена:
С 2 Н 5 ОН = С 2 Н 4 + Н 2 О.
Обугливание сахара, целлюлозы, крахмала и др. углеводов при контакте с серной кислотой объясняется также их обезвоживанием:
C 6 H 12 O 6 + 12H 2 SO 4 = 18H 2 O + 12SO 2 + 6CO 2 .
Любая кислота представляет собой сложное вещество, молекула которого содержит один или несколько атомов водорода и кислотный остаток.
Формула серной кислоты - H2SO4. Следовательно, в состав молекулы серной кислоты входят два атома водорода и кислотный остаток SO4.
Образуется серная кислота при взаимодействии оксида серы с водой
SO3+H2O -> H2SO4
Чистая 100%-я серная кислота (моногидрат) - тяжёлая жидкость, вязкая как масло, без цвета и запаха, с кислым «медным» вкусом. Уже при температуре +10 °С она застывает и превращается в кристаллическую массу.
Концентрированная серная кислота содержит приблизительно 95% H2 SO4. И застывает она при температуре ниже –20°С.
Взаимодействие с водой

Серная кислота хорошо растворяется в воде, смешиваясь с ней в любых соотношениях. При этом выделяется большое количество тепла.
Серная кислота способна поглощать пары воды из воздуха. Это её свойство используют в промышленности для осушения газов. Осушают газы, пропуская их через специальные ёмкости с серной кислотой. Конечно же, этот способ можно применять только для тех газов, которые не вступают в реакцию с ней.
Известно, что при попадании серной кислоты на многие органические вещества, особенно углеводы, эти вещества обугливаются. Дело в том, что углеводы, как и вода, содержат и водород, и кислород. Серная кислота отнимает у них эти элементы. Остаётся уголь.
В водном растворе H2SO4 индикаторы лакмус и метиловый оранжевый окрашиваются в красный цвет, что говорит о том, что этот раствор имеет кислый вкус.
Взаимодействие с металлами
Как и любая другая кислота, серная кислота способна замещать атомы водорода на атомы металла в своей молекуле. Взаимодействует она практически со всеми металлами.
В разбавленном виде серная кислота реагирует с металлами как обычная кислота. В результате реакции образуется соль с кислотным остатком SO4 и водород.
Zn + H2SO4 = ZnSO4 + H2
А концентрированная серная кислота является очень сильным окислителем. Она окисляет все металлы, независимо от их положения в ряду напряжений. И при реакции с металлами она сама восстанавливается до SO2. Водород не выделяется.
Сu + 2 H2SO4 (конц) = CuSO4 + SO2 + 2H2O
Zn + 2 H2SO4 (конц) = ZnSO4 + SO2 + 2H2O
А вот золото, железо, алюминий, металлы платиновой группы в серной кислоте не окисляются. Поэтому серную кислоту перевозят в стальных цистернах.
Сернокислые соли, которые получаются в результате таких реакций, называют сульфатами. Они не имеют цвета, легко кристаллизуются. Некоторые из них хорошо растворяются в воде. Малорастворимыми являются только CaSO4 и PbSO4 . Почти не растворяется в воде BaSO4.
Взаимодействие с основаниями

Реакция взаимодействия кислоты с основаниями называется реакцией нейтрализации. В результате реакции нейтрализации серной кислоты образуется соль, содержащая кислотный остаток SO4, и вода H2O.
Примеры реакций нейтрализации серной кислоты:
H2SO4 + 2 NaOH = Na2SO4 + 2 H2O
H2SO4 + CaOH = CaSO4 + 2 H2O
Серная кислота вступает в реакцию нейтрализации как с растворимыми, так и с нерастворимыми основаниями.
Так как в молекуле серной кислоты два атома водорода, и для её нейтрализации требуется два основания, то она относится к двухосновным кислотам.
Взаимодействие с основными оксидами
Из школьного курса химии нам известно, что оксидами называют сложные вещества, в состав которых входят два химических элемента, одним из которых является кислород в степени окисления -2 . Основными оксидами называют оксиды 1, 2 и некоторых 3 валентных металлов. Примеры основных оксидов: Li2O, Na2O, CuO, Ag2O, MgO, CaO, FeO, NiO.
С основными оксидами серная кислота вступает в реакцию нейтрализации. В результате такой реакции, как и в реакции с основаниями, образуются соль и вода. Соль содержит кислотный остаток SO4.
CuO + H2SO4 = CuSO4 + H2O
Взаимодействие с солями
Серная кислота взаимодействует с солями более слабых или летучих кислот, вытесняя из них эти кислоты. В результате такой реакции образуется соль с кислотным остатком SO4 и кислота
H2SO4+BaCl2=BaSO4+2HCl
Применение серной кислоты и её соединений

Бариева каша ВaSO4 способна задерживать рентгеновские лучи. Заполняя ею полые органы человеческого организма, рентгенологи исследуют их.
В медицине и строительстве широко применяют природный гипс CaSO4 * 2H2O, кристаллогидрат сульфата кальция. Глауберова соль Na2SO4 * 10H2O используется в медицине и ветеринарии, в химической промышленности - для производства соды и стекла. Медный купорос CuSO4 * 5H2O известен садоводам и агрономам, которые используют его для борьбы с вредителями и болезнями растений.
Серная кислота широко используется в различных отраслях промышленности: химической, металлообрабатывающей, нефтяной, текстильной, кожевенной и других.
Структурная формула
Истинная, эмпирическая, или брутто-формула: H 2 SO 4
Химический состав Серной кислоты
Молекулярная масса: 98,076
Серная кислота H 2 SO 4 - сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях концентрированная серная кислота - тяжёлая маслянистая жидкость без цвета и запаха, с кислым «медным» вкусом. В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO 3 . Если молярное отношение SO 3: H 2 O меньше 1, то это водный раствор серной кислоты, если больше 1 - раствор SO 3 в серной кислоте (олеум).
Название
В XVIII-XIX веках серу для пороха производили из серного колчедана (пирит) на купоросных заводах. Серную кислоту в то время называли «купоросным маслом» (как правило это был кристаллогидрат, по консистенции напоминающий масло), очевидно отсюда происхождение названия её солей (а точнее именно кристаллогидратов) - купоросы.
Получение серной кислоты
Промышленный (контактный) способ
В промышленности серную кислоту получают окислением диоксида серы (сернистый газ, образующийся в процессе сжигания серы или серного колчедана) до триоксида (серного ангидрида)с последующим взаимодействием SO 3 с водой. Получаемую данным способом серную кислоту также называют контактной (концентрация 92-94 %).
Нитрозный (башенный) способ
Раньше серную кислоту получали исключительно нитрозным методом в специальных башнях, а кислоту называли башенной (концентрация 75 %). Сущность этого метода заключается в окислении диоксида серы диоксидом азота в присутствии воды.
Другой способ
В тех редких случаях, когда сероводород (H 2 S) вытесняет сульфат(SO 4 -) из соли (с металлами Cu,Ag,Pb,Hg) побочным продуктом является серная кислота. Сульфиды данных металлов обладают высочайшей прочностью, а также отличительным чёрным окрасом.
Физические и физико-химические свойства
Очень сильная кислота, при 18 о С pK a (1) = −2,8, pK a (2) = 1,92 (К z 1,2 10 -2); длины связей в молекуле S=O 0,143 нм, S-OH 0,154 нм, угол HOSOH 104°, OSO 119°; кипит, образуя азеотропную смесь (98,3 % H 2 SO 4 и 1,7 % H 2 О с температурой кипения 338,8 о С). Серная кислота, отвечающая 100%-ному содержанию H 2 SO 4 , имеет состав (%): H 2 SO 4 99,5, HSO 4 - - 0,18, H 3 SO 4 + - 0,14, H 3 O + - 0,09, H 2 S 2 O 7 , - 0,04, HS 2 O 7 - - 0,05. Смешивается с водой и SO 3 , во всех соотношениях. В водных растворах серная кислота практически полностью диссоциирует на H 3 О + , HSO 3 + , и 2НSO 4 - . Образует гидраты H 2 SO 4 ·nH 2 O, где n = 1, 2, 3, 4 и 6,5.
Олеум
Растворы серного ангидрида SO 3 в серной кислоте называются олеумом, они образуют два соединения H 2 SO 4 ·SO 3 и H 2 SO 4 ·2SO 3 . Олеум содержит также пиросерные кислоты. Температура кипения водных растворов серной кислоты повышается с ростом её концентрации и достигает максимума при содержании 98,3 % H 2 SO 4 . Температура кипения олеума с увеличением содержания SO 3 понижается. При увеличении концентрации водных растворов серной кислоты общее давление пара над растворами понижается и при содержании 98,3 % H 2 SO 4 достигает минимума. С увеличением концентрации SO 3 в олеуме общее давление пара над ним повышается. Давление пара над водными растворами серной кислоты и олеума можно вычислить по уравнению:
lg p=A-B/T+2,126
величины коэффициентов А и В зависят от концентрации серной кислоты. Пар над водными растворами серной кислоты состоит из смеси паров воды, H 2 SO 4 и SO 3 , при этом состав пара отличается от состава жидкости при всех концентрациях серной кислоты, кроме соответствующей азеотропной смеси. С повышением температуры усиливается диссоциация. Максимальную вязкость имеет олеум H 2 SO 4 ·SO 3 , с повышением температуры η снижается. Электрическое сопротивление серной кислоты минимально при концентрации SO 3 и 92 % H 2 SO 4 и максимально при концентрации 84 и 99,8 % H 2 SO 4 . Для олеума минимальное ρ при концентрации 10 % SO 3 . С повышением температуры ρ серной кислоты увеличивается. Диэлектрическая проницаемость 100%-ной серной кислоты 101 (298,15 К), 122 (281,15 К); криоскопическая постоянная 6,12, эбулиоскопическая постоянная 5,33; коэффициент диффузии пара серной кислоты в воздухе изменяется в зависимости от температуры; D = 1,67·10⁻⁵T3/2 см²/с.
Химические свойства
Серная кислота в концентрированном виде при нагревании - довольно сильный окислитель. Окисляет HI и частично HBr до свободных галогенов. Окисляет многие металлы (исключения: Au, Pt, Ir, Rh, Ta.). При этом концентрированная серная кислота восстанавливается до SO 2 . На холоде в концентрированной серной кислоте Fe, Al, Cr, Co, Ni, Ba пассивируются и реакции не протекают. Наиболее сильными восстановителями концентрированная серная кислота восстанавливается до S и H 2 S. Концентрированная серная кислота поглощает водяные пары, поэтому она применяется для сушки газов, жидкостей и твёрдых тел, например, в эксикаторах. Однако концентрированная H 2 SO 4 частично восстанавливается водородом, из-за чего не может применяться для его сушки. Отщепляя воду от органических соединений и оставляя при этом чёрный углерод (уголь), концентрированная серная кислота приводит к обугливанию древесины, сахара и других веществ. Разбавленная H 2 SO 4 взаимодействует со всеми металлами, находящимися в электрохимическом ряду напряжений левее водорода с его выделением. Окислительные свойства для разбавленной H 2 SO 4 нехарактерны. Серная кислота образует два ряда солей: средние - сульфаты и кислые - гидросульфаты, а также эфиры. Известны пероксомоносерная (или кислота Каро) H 2 SO 5 и пероксодисерная H 2 S 2 O 8 кислоты. Серная кислота реагирует также с основными оксидами, образуя сульфат и воду. На металлообрабатывающих заводах раствор серной кислоты применяют для удаления слоя оксида металла с поверхности металлических изделий, подвергающихся в процессе изготовления сильному нагреванию. Так, оксид железа удаляется с поверхности листового железа действием нагретого раствора серной кислоты. Качественной реакцией на серную кислоту и её растворимые соли является их взаимодействие с растворимыми солями бария, при котором образуется белый осадок сульфата бария, нерастворимый в воде и кислотах, например.
Применение
Серную кислоту применяют:
- в обработке руд, особенно при добыче редких элементов, в том числе урана, иридия, циркония, осмия и т. п.;
- в производстве минеральных удобрений;
- как электролит в свинцовых аккумуляторах;
- для получения различных минеральных кислот и солей;
- в производстве химических волокон, красителей, дымообразующих и взрывчатых веществ;
- в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности;
- в пищевой промышленности - зарегистрирована в качестве пищевой добавки E513 (эмульгатор);
- в промышленном органическом синтезе в реакциях:
- дегидратации (получение диэтилового эфира, сложных эфиров);
- гидратации (этанол из этилена);
- сульфирования (синтетические моющие средства и промежуточные продукты в производстве красителей);
- алкилирования (получение изооктана, полиэтиленгликоля, капролактама) и др.
- Для восстановления смол в фильтрах на производстве дистилированной воды.
Мировое производство серной кислоты ок. 160 млн тонн в год. Самый крупный потребитель серной кислоты - производство минеральных удобрений. На P 2 O 5 фосфорных удобрений расходуется в 2,2-3,4 раза больше по массе серной кислоты, а на (NH 4) 2 SO 4 серной кислоты 75 % от массы расходуемого (NH 4) 2 SO 4 . Поэтому сернокислотные заводы стремятся строить в комплексе с заводами по производству минеральных удобрений.
Исторические сведения
Серная кислота известна с древности, встречаясь в природе в свободном виде, например, в виде озёр вблизи вулканов. Возможно, первое упоминание о кислых газах, получаемых при прокаливании квасцов или железного купороса «зеленого камня», встречается в сочинениях, приписываемых арабскому алхимику Джабир ибн Хайяну. В IX веке персидский алхимик Ар-Рази, прокаливая смесь железного и медного купороса (FeSO 4 7H 2 O и CuSO 4 5H 2 O), также получил раствор серной кислоты. Этот способ усовершенствовал европейский алхимик Альберт Магнус, живший в XIII веке. Схема получения серной кислоты из железного купороса - термическое разложение сульфата железа (II) с последующим охлаждением смеси. В трудах алхимика Валентина (XIII в) описывается способ получения серной кислоты путём поглощения водой газа (серный ангидрид), выделяющегося при сжигании смеси порошков серы и селитры. Впоследствии этот способ лег в основу т. н. «камерного» способа, осуществляемого в небольших камерах, облицованных свинцом, который не растворяется в серной кислоте. В СССР такой способ просуществовал вплоть до 1955 г. Алхимикам XV в известен был также способ получения серной кислоты из пирита - серного колчедана, более дешевого и распространенного сырья, чем сера. Таким способом получали серную кислоту на протяжении 300 лет, небольшими количествами в стеклянных ретортах. Впоследствии, в связи с развитием катализа этот метод вытеснил камерный способ синтеза серной кислоты. В настоящее время серную кислоту получают каталитическим окислением (на V 2 O 5) оксида серы (IV) в оксид серы (VI), и последующим растворением оксида серы (VI) в 70 % серной кислоте с образованием олеума. В России производство серной кислоты впервые было организовано в 1805 году под Москвой в Звенигородском уезде. В 1913 году Россия по производству серной кислоты занимала 13 место в мире.
Дополнительные сведения
Мельчайшие капельки серной кислоты могут образовываться в средних и верхних слоях атмосферы в результате реакции водяного пара и вулканического пепла, содержащего большие количества серы. Получившаяся взвесь, из-за высокого альбедо облаков серной кислоты, затрудняет доступ солнечных лучей к поверхности планеты. Поэтому (а также в результате большого количества мельчайших частиц вулканического пепла в верхних слоях атмосферы, также затрудняющих доступ солнечному свету к планете) после особо сильных вулканических извержений могут произойти значительные изменения климата. Например, в результате извержения вулкана Ксудач (Полуостров Камчатка, 1907 г.) повышенная концентрация пыли в атмосфере держалась около 2 лет, а характерные серебристые облака серной кислоты наблюдались даже в Париже. Взрыв вулкана Пинатубо в 1991 году, отправивший в атмосферу 3·10 7 тонн серы, привёл к тому, что 1992 и 1993 года были значительно холоднее, чем 1991 и 1994.
Стандарты
- Кислота серная техническая ГОСТ 2184-77
- Кислота серная аккумуляторная. Технические условия ГОСТ 667-73
- Кислота серная особой чистоты. Технические условия ГОСТ 1422-78
- Реактивы. Кислота серная. Технические условия ГОСТ 4204-77
Имеет историческое название: купоросное масло. Изучение кислоты началось с древних времен, в своих трудах ее описывали: греческий врач Диоскорид, римский натуралист Плиний Старший, исламские алхимики Гебер, Рази и Ибн Сина, другие. В Шумерах существовал перечень купоросов, которые классифицировались по цвету вещества. В наше время слово «купорос» объединяет кристаллогидраты сульфатов двухвалентных металлов.
В 17 веке, германо-голландский химик Иоган Глаубер получил серную кислоту путем сжигания серы с (KNO3) в присутствии В 1736 году Джошуа Уорд (фармацевт из Лондона) этот метод использовал в производстве. Это время можно считать точкой отсчета, когда в уже крупных масштабах стала выпускаться серная кислота. Формула ее (H2SO4), как принято считать, была установлена шведским химиком Берцелиусом (1779—1848) немого позже.
Берцелиус при помощи буквенных символов (обозначают химические элементы) и нижних цифровых индексов (указывают на количество в молекуле атомов данного вида) установил, что в одной молекуле содержится 1 атом серы (S), 2 атома водорода (H) и 4 атома кислорода (O). С этого времени стал известен качественный и количественный состав молекулы, то есть на языке химии описана серная кислота.
Показывающая в графическом виде взаимное расположение в молекуле атомов и химических связей между ними (их принято обозначать линиями), информирует, что в центре молекулы находится атом серы, который связан двойными связями с двумя атомами кислорода. С другими двумя атомами кислорода, к каждому из которых прикреплен атом водорода, этот же атом серы соединен одинарными связями.
Свойства
Серная кислота — слегка желтоватая или бесцветная, вязкая жидкость, растворимая в воде при любых концентрациях. Она является сильной минеральной отличается высокой агрессивностью по отношению к металлам (концентрированная не взаимодействует с железом без нагревания, а пассивирует его), горным породам, тканям животных или другим материалам. Характеризуется высокой гигроскопичностью и ярко выраженными свойствами сильного окислителя. При температуре 10,4 оС кислота затвердевает. При нагревании до 300 оС почти 99 % кислота теряет серный ангидрид (SO3).
Свойства ее меняются в зависимости от концентрации ее водного раствора. Существуют общепринятые названия растворов кислоты. Разбавленной кислота считается до 10 %. Аккумуляторная — от 29 до 32 %. При концентрации менее 75 % (как установлено в ГОСТ 2184) ее называют башенной. Если концентрация 98 %, то это будет уже серная кислота концентрированная. Формула(химическая или структурная) во всех случаях остается неизменной.
При растворении в серной кислоте концентрированной серного ангидрида образуется олеум или дымящая серная кислота, формула ее может быть записана так: H2S2O7. Чистая кислота (H2S2O7) является твердым веществом с температурой плавления 36 оС. Реакции гидратации серной кислоты характеризуются выделением тепла в большом количестве.
Разбавленная кислота вступает в реакцию с металлами, реагируя с которыми, проявляет свойства сильного окислителя. При этом восстанавливается серная кислота, формула образованных веществ, содержащих восстановленный (до +4, 0 или -2) атом серы, может быть: SO2, S или H2S.
Реагирует с неметаллами, например, углеродом или серой:
2 H2SO4 + C → 2 SO2 + CO2 + 2 H2O
2 H2SO4 + S → 3 SO2 + 2 H2O
Вступает в реакцию с хлоридом натрия:
H2SO4 + NaCl → NaHSO4 + HCl
Для нее характерна реакция электрофильного замещения атома водорода, присоединенного к бензольному кольцу ароматического соединения, на группу —SO3H.
Получение
В 1831 году был запатентован контактный метод получения H2SO4, являющийся в настоящее время основным. Сегодня большая часть серной кислоты производится с использованием этого метода. В качестве сырья применяется сульфидная руда (чаще железный колчедан FeS2), который обжигают в специальных печах, при этом образуется обжиговый газ. Так как температура газа равняется 900 оС, то его охлаждают серной кислотой с концентрацией 70 %. Затем газ в циклоне и электрофильтре очищают от пыли, в промывных башнях кислотой с концентрацией 40 и 10 % от каталитических ядов (As2O5 и фтора), на мокрых электрофильтрах от аэрозоля кислоты. Далее обжиговый газ, содержащий 9 % сернистого ангидрида (SO2), осушают и подают в контактный аппарат. Пройдя через 3 слоя ванадиевого катализатора, SO2 окисляется в SO3. Для растворения образовавшегося серного ангидрида применяется концентрированная серная кислота. Формула раствора серного ангидрида (SO3) в безводной серной кислоте представляет собой H2S2O7. В таком виде олеум в стальных цистернах транспортируется к потребителю, где его разбавляют до нужной концентрации.
Применение
Благодаря различным химическим свойствами, H2SO4 имеет широкий спектр применения. В производстве самой кислоты, как электролит в свинцово-кислотных аккумуляторах, для изготовления различных чистящих средств, также является важным реагентом в химической промышленности. Она используется также в производстве: спиртов, пластмасс, красителей, резины, эфира, клеев, мыла и моющих средств, фармацевтической продукции, целлюлозы и бумаги, нефтепродуктов.
Новая тема: Серная кислота – H 2 SO 4
1. Электронная и структурная формулы серой кислоты
*S - сера находится в возбуждённом состоянии 1S 2 2S 2 2P 6 3S 1 3P 3 3d 2
Электронная формула молекулы серной кислоты:
Структурная формула молекулы серной кислоты:
1 H - -2 O -2 O
1 H - -2 O -2 O
2.Получение:
Химические процессы производства серной кислоты можно представить в виде следующей схемы:
S +O 2 +O 2 +H 2 O
FeS 2 SO 2 SO 3 H 2 SO 4
Получают серную кислоту в три стадии:
1стадия. В качестве сырья применяют серу, железный колчедан или сероводород.
4 FeS 2 + 11 O 2 = 2Fe 2 O 3 + 8SO 2
2 стадия . Окисление SO 2 до SO 3 кислородом при помощи катализатора V 2 O 5
2SO 2 +O 2 =2SO 3 +Q
3стадия . Для превращения SO 3 в серную кислот применяют не воду т.к. происходит сильное разогревание, а концентрированный раствор серной кислоты.
SO 3 +H 2 O H 2 SO 4
В результате получают олеум – раствор SO 3 в серной кислоте.
Схема цепи аппаратов (см.учебник стр.105)
3.Физические свойства.
а) жидкость б) бесцветная в)тяжелая (купоросное масло) г)нелетучая
г) при растворении в воде происходит сильное разогревание (поэтому серную кислоту непременно нужно наливать в воду ,а не наоборот!)
4. Химические свойства Серной кислоты.
|
Разбавленная H 2 SO 4 |
Концентрированная H 2 SO 4 |
|
Обладает всеми свойствами кислот |
Обладает специфическими свойствами |
|
1.Изменяет окраску индикатора: H 2 SO 4 H + +HSO 4 - HSO 4 - H + +SO 4 2- 2.Реагирует с металлами, стоящими до водорода: Zn+ H 2 SO 4 ZnSO 4 +H 2 3.Реагирует с основными и амфотерными оксидами: MgO+ H 2 SO 4 MgSO 4 +H 2 O 4.Взаимодействует с основаниям (реакция нейтрализации) 2NaOH+H 2 SO 4 Na 2 SO 4 +2H 2 O при избытке кислоты образуются кислые соли NaOH+H 2 SO 4 NaHSO 4 +H 2 O 5.Реагирует с сухими солями, вытесняя из них другие кислоты (это самая сильная и нелетучая кислота): 2NaCl+H 2 SO 4 Na 2 SO 4 +2HCl 6.Реагирует с растворами солей, если при этом образуется нерастворимая соль: BaCl 2 +H 2 SO 4 BaSO 4 +2HCl - белый осадок качественная реакция на ион SO 4 2- 7.При нагревании разлагается: H 2 SO 4 H 2 O+SO 3 |
1.Концентрированная H 2 SO 4 - сильнейший окислитель, при нагревании она реагирует со всеми металлами (кроме Au и Pt). В этих реакциях в зависимости от активности металла и условий выделяется S,SO 2 или H 2 S Например: Cu+ конц 2H 2 SO 4 CuSO 4 +SO 2 +H 2 O 2.конц. H 2 SO 4 пассивирует железо и алюминий, поэтому её можно перевозить в стальных и алюминиевых цистернах. 3. конц. H 2 SO 4 хорошо поглощает воду H 2 SO 4 +H 2 O H 2 SO 4 *2H 2 O Поэтому она обугливает органические вещества |
5.Применение : Серная кислота -один из важнейших продуктов, используемых в различных отраслях промышленности. Основными её потребителями являются производство минеральных удобрений, металлургия, чистка нефтепродуктов. Серная кислота применяется при производстве других кислот, моющих средств, взрывчатых веществ, лекарств, красок, в качестве электролитов для свинцовых аккумуляторов. (Учебник стр.103).
6.Соли серной кислоты
Серная кислота диссоциирует ступенчато
H 2 SO 4 H + +HSO 4 -
HSO 4 - H + +SO 4 2-
поэтому она образует два вида солее – сульфаты и гидросульфаты
Например: Na 2 SO 4 - сульфат натрия (средняя соль)
Na HSO 4 - гидросульфат натрия (кислая соль)
Наибольшее применение находят:
Na 2 SO 4 * 10H 2 O –глауберова соль (применяется при производстве соды, стекла, в медицине и
ветеринарии.
СaSO 4 *2H 2 O –гипс
СuSO 4 *5H 2 O –медный купорос(применяется в сельском хозяйстве).
Лабораторный опыт
Химические свойства серной кислоты.
Оборудование : Пробирки.
Реактивы: серная кислота, метиловый – оранжевый, цинк, оксид магния, гидроксид натрия и фенолфталеин, карбонат натрия, хлорид бария.
б) Заполни таблицу наблюдений
 Ударение в английском языке
Ударение в английском языке 10 слов с ударением на 1 слог
10 слов с ударением на 1 слог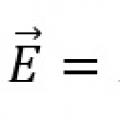 Закон Ома для замкнутой цепи и неоднородного участка цепи
Закон Ома для замкнутой цепи и неоднородного участка цепи