Что входит в состав кости. Кости человека: строение, состав их соединение и устройство суставов. Остеон - структурная единица костной ткани
Межклеточный органический матрикс компактной кости составляет около 20%, неорганические вещества – 70% и вода – 10%. В губчатой кости преобладают органические компоненты, которые составляют более 50%, на долю неорганических соединений приходится 33-40%. Количество воды приблизительно то же, что и в компактной кости.
Органический матрикс костной ткани. Приблизительно 95% органического матрикса приходится на коллаген типа I. Данный тип коллагена входит также в состав сухожилий и кожи, однако коллаген костной ткани обладает некоторыми особенностями. В нем несколько больше оксипролина, а также свободных аминогрупп лизиновых и оксилизиновых остатков. Это обусловливает наличие большего количества поперечных связей в коллагеновых волокнах и их большую прочность. По сравнению с коллагеном других тканей костный коллаген характеризуется повышенным содержанием фосфата, который в основном связан с остатками серина.
Белки неколлагеновой природы представлены гликопротеинами, белковыми компонентами протеогликанов. Принимают участие в росте и развитии кости, процессе минерализации, водно-солевом обмене. Альбумины участвуют в транспорте гормонов и других веществ из крови.
Преобладающим белком неколлагеновой природы является остеокальцин
. Он присутствует только в костях и зубах. Это небольшой (49 аминокислотных остатков) белок, называемаый также костным глутаминовым белком или gla-белком. В молекуле остеокальцина обнаружены три остатка
γ-карбоксиглутаминовой кислоты. За счет этих остатков он способен связывать кальций. Для синтеза остеокальцина необходим витамин К (рис. 34).
Рис. 34. Посттрансляционная модификация остеокальцина
В состав органического матрикса костной ткани входят гликозаминогликаны, основным представителем которых является хондроитин-4-сульфат. Хондроитин-6-сульфат, кератансульфат и гиалуроновая кислота содержатся в небольших количествах. Окостенение сопровождается изменением гликозаминогликанов: сульфатированные соединения уступают место несульфатированным. Гликозаминогликаны участвуют в связывании коллагена с кальцием, регуляции водного и солевого обмена.
Цитрат необходим для минерализации костной ткани. Он образует комплексные соединения с солями кальция и фосфора, обеспечивая возможность повышения концентрации их в ткани до такого уровня, при котором могут начаться кристаллизация и минерализация. Также принимет участие в регуляции уровня кальция в крови. Кроме цитрата, в костной ткани обнаружены сукцинат, фумарат, малат, лактат и другие органические кислоты.
Костный матрикс содержит небольшое количество липидов. Липиды играют существенную роль в образовании ядер кристаллизации при минерализации кости.
Остеобласты богаты РНК. Высокое содержание РНК в костных клетках отражает их активность и постоянную биосинтетическую функцию.
Неорганический состав костной ткани.
В раннем возрасте в костной ткани преобладает аморфныйм фосфат кальция Са 3 (РО 4) 2 . В зрелой кости преобладающим становится кристаллический гидроксиапатит Са 10 (РО 4) 6 (ОН) 2 (рис. 35). Его кристаллы имеют форму пластин или палочек. Обычно аморфный фосфат кальция рассматривают как лабильный резерв ионов Са 2+ и фосфата.
В состав минеральной фазы кости входят ионы натрия, магния, калия, хлора и др. В кристаллической решетке гидроксиапатита ионы Са 2+ могут замещаться другими двухвалентными катионами, тогда как анионы, отличные от фосфата и гидроксила, либо адсорбируются на поверхности кристаллов, либо растворяются в гидратной оболочке кристаллической решетки.

Рис. 35. Строение кристалла гидроксиапатита
Метаболизм костной ткани характеризуется двумя противоположными процессами: образованием новой костной ткани остеобластами и резорбцией (деградацией) старой остеокластами. В норме количество новообразованной ткани эквивалентно разрушенной. Костная ткань скелета человека практически полностью перестраивается в течение 10 лет.
Образование костной ткани
На1 этапе
остеобласты синтезируют сначала протеогликаны и гликозаминогликаны, образующие матрикс, а затем продуцируют фибриллы костного коллагена, которые распределяются в матриксе. Костный коллаген является матрицей для процесса минерализации. Необходимым условием процесса минерализации является пересыщение среды ионами кальция и фосфора. Образование кристаллов минерального остова кости запускают
Са-связывающие белки на матрице коллагена. Остеокальцин прочно связан с гидроксиапатитом и участвует в регуляции роста кристаллов за счет связывания Са 2+ в костях. Электронномикроскопические исследования показали, что формирование минеральной кристаллической решетки начинается в зонах, находящихся в регулярных промежутках между коллагеновыми фибриллами. Образовавшиеся кристаллы в зоне коллагена затем в свою очередь становятся ядрами минерализации, где в пространстве между коллагеновыми волокнами откладывается гидроксиапатит.
На 2 этапе в зоне минерализации при участии лизосомных протеиназ происходит деградация протеогликанов; усиливаются окислительные процессы, распадается гликоген, синтезируется необходимое количество АТФ. Кроме того, в остеобластах увеличивается количество цитрата, необходимого для синтеза аморфного фосфата кальция.
По мере минерализации костной ткани кристаллы гидроксиапатита вытесняют не только протеогликаны, но и воду. Плотная, полностью минерализованная кость практически обезвожена.
Фермент щелочная фосфатаза принимает участие в минерализации. Одним из механизмов ее действия является локальное увеличение концентрации ионов фосфора до точки насыщения, за которым следуют процессы фиксации кальций-фосфорных солей на органической матрице кости. При восстановлении костной ткани после переломов содержание щелочной фосфатазы в костной мозоли резко увеличивается. При нарушении костеобразования наблюдается уменьшение содержания и активности щелочной фосфатазы в костях, плазме и в других тканях.
Ингибитором кальцификации является неорганический пирофосфат. Ряд исследователей считают, что процессу минерализации коллагена в коже, сухожилиях, сосудистых стенках препятствует постоянное наличие в этих тканях протеогликанов.
Процессы моделирования и ремоделирования обеспечивают постоянное обновление костей, а также модификацию их формы и структуры. Моделирование (образование новой кости) имеет место в основном в детском возрасте. Ремоделирование является доминирующим процессом в скелете взрослых; в этом случае происходит лишь замена отдельного участка старой кости. Таким образом, в физиологических и патологическтх условиях происходит не только образование, но и резорбция костной ткани.
Катаболизм костной ткани
Практически одновременно имеет место «рассасывание» как минеральных, так и органических структур костной ткани. При остеолизе усиливается продукция органических кислот, что приводит к сдвигу рН в кислую сторону. Это способствует растворению минеральных солей и их удалению.
Резорбция органического матрикса происходит под действием лизосомных кислых гидролаз, спектр которых в костной ткани довольно широк. Они участвуют во внутриклеточном переваривании фрагментов резорбируемых структур.
При всех заболеваниях скелета происходят нарушения процессов ремоделирования кости, что сопровождается возникновением отклонений в уровне биохимических маркеров.
Имеются общие маркеры формирования новой костной ткани , такие как костно-специфическая щелочная фосфатаза, остеокальцин плазмы, проколлаген I, пептиды плазмы. К биохимическим маркерам резорбции кости относятся кальций в моче и гидроксипролин, пиридинолин мочи и дезоксипиридинолин, являющиеся производными поперечных волокон коллагена, специфичных для хрящей и костей.
Факторами , влияющими на метаболизм костной ткани, являются гормоны, ферменты и витамины.
Минеральные компоненты костной ткани находятся практически в состоянии химического равновесия с ионами кальция и фосфата сыворотки крови. В регуляции поступления, депонирования и выделения кальция и фосфата важную роль играют паратгормон и кальцитонин.
Действие паратгормона приводит к увеличению числа остеокластов и их метаболической активности. Остеокласты способствуют ускоренному растворению содержащихся в костях минеральных соединений. Таким образом, происходит активация клеточных систем, участвующие в резорбции кости.
Паратгормон увеличивает также реабсорбцию ионов Са 2+ в почечных канальцах. Суммарный эффект проявляется в повышении уровня кальция в сыворотке крови.
Действие кальцитонина состоит в снижении концентрации ионов Са 2+ за счет отложения его в костной ткани. Он активирует ферментную систему остеобластов, повышает минерализацию кости и уменьшает число остеокластов в зоне действия, т. е. угнетает процесс костной резорбции. Все это увеличивает скорость формирования кости.
Витамин D участвует в биосинтезе Са 2+ -связывающих белков, стимулирует всасывание калиция в кишечнике, повышает реабсорбцию кальция, фосфора, натрия, цитрата, аминокислот в почках. При недостатке витамина D эти процессы нарушаются. Прием в течение длительного времени избыточных количеств витамина D приводит к деминерализации костей и увеличению концентрации кальция в крови.
Кортикостероиды увеличивают синтез и секрецию паратгормона, усиливают деминерализацию кости; половые гормоны ускоряют созревание и сокращают период роста кости; тироксин усиливает рост и дифференцировку ткани.
Действие витамина С на метаболизм костной ткани обусловлено, прежде всего, влиянием на процессе биосинтеза коллагена. Аскорбиновая кислота является кофактором пролил- и лизилгидроксилаз и необходима для осуществления реакции гидроксилирования пролина и лизина. Недостаток витамина С приводит также к изменениям в синтезе гликозаминогликанов: содержание гиалуроновой кислоты в костной ткани увеличивается в несколько раз, тогда как биосинтез хондроитинсульфатов замедляется.
При недостатке витамина А происходит изменение формы костей, нарушение минерализации, задержка роста. Считают, что данный факт обусловлен нарушением синтеза хондроитинсульфата. Высокие дозы витамина А приводят к избыточной резорбции кости.
При недостатке витаминов группы В рост кости замедляется, что связано с нарушением белкового и энергетического обмена.
Особенности зубной ткани
Основную часть зуба составляет дентин . Выступающая из десны часть зуба, коронка, покрыта эмалью , а корень зуба покрыт зубным цементом . Цемент, дентин и эмаль построены подобно костной ткани. Белковый матрикс этих тканей состоит главным образом из коллагенов и протеогликанов. Содержание органических компонентов в цементе – около 13%, в дентине – 20%, в эмали – всего 1-2%. Высокое содержание минеральных веществ (эмаль – 95%, дентин – 70%, цемент – 50%) определяет высокую твердость зубной ткани. Наиболее важным минеральным компонентом является гидроксиапатит [Са 3 РО 4) 2 ] 3 Са(ОН) 2 . Содержатся также карбонатный апатит, хлорапатит и стронцевый апатит.
Эмаль, покрывающая зуб, полупроницаема. Она участвует в обмене ионами и молекулами со слюной. На проницаемость эмали влияют рН слюны, а также ряд химических факторов.
В кислой среде ткань зуба подвергается атаке и утрачивает твердость. Такое распространенное заболевание, как кариес , вызывается микроорганизмами, живущими на поверхности зубов и выделяющими в качестве продукта анаэробного гликолиза органические кислоты, вымывающие из эмали ионы Са 2+ .
Контрольные вопросы
1. Назовите основные органические компоненты костной ткани.
2. Какие неорганические соединения входят в состав костной ткани?
3. В чем различие биохимических процессов, протекающих в остеокластах и остеобластах?
4. Опишите процесс формирования кости.
5. Какие факторы влияют на формирование костной ткани и ее метаболизм?
6. Какие вещества могут быть биохимическими маркерами процессов, протекающих в костной ткани?
7. Каковы особенности биохимического состава зубной ткани?
Литература
1. Березов, Т.Т. Биологическая химия. / Т.Т. Березов, Б.Ф. Коровкин. - М.: ОАО «Издательство «Медицина»», 2007. - 704 с.
2. Биохимия. / Под ред. Е.С. Северина. - М.: ГЭОТАР-Медиа, 2014. -
768 с.
3. Биологическая химия с упражнениями и задачами. / Под ред. Е.С. Северина. - М.: ГЭОТАР-Медиа, 2013. - 624 с.
4. Зубаиров, Д.М. Руководство к лабораторным занятиям по биологической химии. / Д.М. Зубаиров, В.Н. Тимербаев, В.С. Давыдов. - М.: ГЭОТАР-Медиа, 2005. - 392 с.
5. Шведова, В.Н. Биохимия. /В.Н. Шведова. – М.: Юрайт, 2014. – 640 с.
6. Николаев, А.Я. Биологическая химия. / А.Я. Николаев. - М.: Медицинское информационное агентство, 2004. - 566 с.
7. Кушманова, О.Б. Руководство к лабораторным занятиям по биологической химии. / О.Б. Кушманова, Г.И. Ивченко. - М. - 1983.
8. Ленинджер, А. Основы биохимии / А. Ленинджер. - М., «Мир». - 1985.
9. Марри, Р. Биохимия человека. / Р. Марри, Д. Греннер, П. Мейес, В. Родуэлл. - Т. 1. - М.: Мир, 1993. - 384 с.
10. Марри, Р. Биохимия человека. / Р. Марри, Д. Греннер, П. Мейес, В. Родуэлл. - Т. 2. - М.: Мир, 1993. - 415 с.
Оглавление [Показать]
Со школьных уроков по химии каждому известно, что человеческий организм содержит в себе практически все элементы из периодической таблицы Д. И. Менделеева. Процентное содержание некоторых весьма значительно, а другие присутствуют лишь в следовых количествах. Но каждый из химических элементов, находящихся в организме, выполняет свою важную роль. В человеческом теле минеральные вещества содержатся в виде солей, органические представлены как углеводы, белки и прочие. Дефицит или избыток какого-либо из них приводит к нарушению нормальной жизнедеятельности.
В химический состав костей входит ряд элементов и их веществ, в больше степени это соли кальция и коллаген, а также другие, процентное содержание которых значительно меньше, но роль их не менее значима. Прочность и здоровье скелета зависит от сбалансированности состава, который, в свою очередь, определяется множеством факторов, начиная от здорового питания и заканчивая экологической обстановкой окружающей среды.
В химический состав костей входят вещества органического и неорганического происхождения. Ровно половина массы – это вода, остальные 50% делят оссеин, жир и известковые, фосфорные соли кальция и магния, а также хлористый натрий. На минеральную часть приходится порядка 22%, а органическая, представленная белками, полисахаридами, лимонной кислотой и ферментами, заполняет примерно 28%. В костях содержится 99% кальция, который есть в человеческом теле. Схожий компонентный состав имеют зубы, ногти и волосы.
В анатомической лаборатории можно провести следующий анализ, чтобы подтвердить химический состав костей. Для определения органической части ткань подвергают действию раствора кислоты средней силы, например, соляной, концентрации порядка 15%. В образовавшейся среде происходит растворение солей кальция, а оссеиновый «скелет» остаётся нетронутым. Такая кость приобретает максимальное свойство эластичности, её в прямом смысле можно завязать в узел.
Неорганическую компоненту, входящую в химический состав костей человека, можно выделить путём выжигания органической части, она легко окисляется до углекислого газа и воды. Минеральный остов характеризуется прежней формой, но крайней хрупкостью. Малейшее механическое воздействие — и он просто рассыплется.
При попадании костей в почву бактерии перерабатывают органическое вещество, а минеральная часть полностью пропитывается кальцием и превращается в камень. В местах, где нет доступа влаги и микроорганизмов, ткани со временем подвергаются естественной мумификации.
Любой учебник по анатомии расскажет про химический состав и строение костей. На клеточном уровне ткань определяется как особый тип соединительной. В основе лежат коллагеновые волокна, окруженные пластинками, составленными из кристаллического вещества – минерала кальция – гидроксилаппатита (основного фосфата). Параллельно располагаются звёздоподобные пустоты, содержащие костные клетки и кровеносные сосуды. Благодаря своему уникальному микроскопическому строению такая ткань отличается удивительной легкостью.
Нормальная работа опорно-двигательной системы зависит от того, каков химический состав костей, в достаточном ли количестве содержатся органические и минеральные вещества. Известковые и фосфорные соли кальция, которые составляют 95% неорганической части скелета, и некоторые другие минеральные соединения определяют свойство твёрдости и прочности кости. Благодаря им ткань устойчива к серьёзным нагрузкам.
Коллагеновая компонента и её нормальное содержание отвечают за такую функцию, как упругость, устойчивость к сжатию, растяжению, перегибу и прочим механическим воздействиям. Но только в согласованном «союзе» органика и минеральная составляющая обеспечивают костной ткани те уникальные свойства, которыми она обладает.
Процентное соотношение веществ, говорящее о том, каков химический состав костей человека, может варьироваться у одного и того же представителя. В зависимости от возраста, образа жизни и других факторов влияния, количество тех или иных соединений может меняться. В частности, у детей костная ткань только формируется и состоит в большей степени из органической компоненты — коллагена. Поэтому скелет ребёнка более гибкий и эластичный.
Для правильного формирования тканей ребёнка крайне важно потребление витаминов. В частности, такого, как Д3. Только в его присутствии химический состав костей в полной мере пополняется кальцием. Дефицит этого витамина может привести к развитию хронических заболеваний и излишней хрупкости скелета из-за того, что ткань вовремя не наполнилась солями Са2+.
Химический состав костей человека, прошедшего подростковый возраст, значительно отличается от детского. Теперь соотношение минеральной и оссеиновой частей примерно сравниваются. Исчезает особая гибкость костной ткани, зато прочность скелета за счёт неорганической составляющей увеличивается в разы. Физические свойства её сравнимы с железобетонной конструкцией или чугуном, а упругость даже больше, чем у древесины дуба.
В полном объёме обеспечить сбалансированный химический состав костей человека (таблица, приведённая ниже, содержит данные о нормальном процентном содержании всех веществ, составляющих скелет) можно благодаря правильному образу жизни, рациональному питанию и заботе о здоровье.
Химический состав костей человека нарушается к старости, что приводит к серьёзным последствиям. Люди преклонного возраста жалуются на проблемы с опорно-двигательной системой, у них чаще случаются переломы, которые заживают дольше, чем у ребенка или взрослого. Это следствие увеличения содержания неорганических солей в составе скелета, их количество доходит до 80%. Нехватка коллагена, следовательно, уменьшение такого свойства, как упругость, приводит к тому, что кости становятся крайне хрупкими. Восстановление баланса возможно с помощью специальных медицинских препаратов, но всё равно этот процесс невозможно остановить или повернуть вспять. Такова физиологическая особенность организма.
Для здоровья и нормальной работы скелета необходимо с детства следить за правильным наполнением костной ткани всеми химическими элементами и соединениями, только в этом случае представляется возможность вести полноценный и активный образ жизни.
Костная ткань имеет структуру с гениально воплощенной архитектурой, которая сочетает взаимоисключающие характеристики: плотность и упругость, легкость и способность выдерживать серьезные нагрузки.
Из чего состоит кость? Из клеточных элементов, органического матрикса и минеральных веществ.
Органический матрикс, или остеоид, на 90% состоит из коллагена. Фибриллы коллагена формируют пластины, которые расположены либо параллельно друг другу, либо концентрически вокруг кровеносных сосудов, образуя при этом каналы, соединенные более мелкими канальцами. На фоне эндокринных, хронических воспалительных заболеваний, в первую очередь ревматических, геометрия костной ткани нарушается.
Минеральная часть кости представлена преимущественно кальцием и фосфатом, микроэлементами (магнием, марганцем, цинком, селеном и бором). Для нормальной минерализации кости необходимо поддержание определенных концентраций микроэлементов.
Формирование костной ткани в детстве и сохранение баланса между процессами образования и резорбции (рассасывании) кости в течение всей жизни происходят в организме под контролем различных внешних и внутренних факторов, зависят от пола, возраста, наследственности, характера питания, физических нагрузок, состояния здоровья и многого другого.
Ремоделирование кости (образование и резорбция) - процесс, при котором неорганические вещества (минералы) откладываются в органический матрикс. Кость формируют клетки - остеобласты, которые синтезируют и секретируют органический матрикс и снабжены большим количеством рецепторов гормонов, витамина D, простагландинов и других биологических субстанций, необходимых для ее питания и работы.
Сразу после образования матрикса начинается его минерализация, которая заканчивается через несколько недель. В процессе минерализации остеобласты превращаются в остеоциты - полностью интегрированные в кость и имеющие очень низкую метаболическую активность клетки (т.е. с очень медленным, по сравнению с другими клетками, обменом веществ). Резорбцию кости осуществляют остеокласты, активно синтезируя и секретируя во внеклеточное пространство ферменты, осуществляющие растворение и переработку отслуживших клеток. Регуляция ремоделирования кости происходит при участии нейроэндокринной системы. Прямое влияние на активность остеобластов и остеокластов оказывают гормоны щитовидной, па- ращитовидной, поджелудочной и половых желез, надпочечников и других эндокринных органов. В последние годы большое внимание уделяется изучению роли иммунной системы в регуляции ремоделирования.
Остеопороз - системное заболевание скелета, которое характеризуется уменьшением костной массы и нарушением костной ткани на молекулярном уровне, что приводит к снижению прочности кости и, следовательно, к повышению риска переломов.
Заболевание встречается во всех возрастных группах, диагностируется как у женщин, так и у мужчин, может протекать бессимптомно, и часто первым его признаком является перелом. Именно переломы, связанные с остеопорозом , представляют огромную социальную и экономическую проблему, служат причиной низкого качества жизни, инвалидизации и преждевременной смерти. Установлено, что увеличение доли пожилых людей среди населения разных стран мира приведет к повышению частоты остеопороза и его осложнений: к 2050 г. в Европе прогнозируется увеличение частоты переломов бедра на 46% по сравнению с 1990 г. Всемирная организация здравоохранения (ВОЗ) официально определила остеопороз как одно из десяти важнейших хронических заболеваний человечества. При этом специалисты подчеркивают, что остеопороз можно предупредить и излечить. На сегодняшний день определены факторы риска и механизмы патогенеза остеопороза , разработаны методы его первичной и вторичной профилактики, совершенствуются способы лечения с использованием различных групп лекарственных средств, в том числе генно-инженерных биологических препаратов.
По мнению большинства геронтологов, старческий остеопороз начинается в детстве. Нарушается ремоделирование кости, возникают количественные и качественные изменения костной ткани, переломы, которые могут стать причиной ранней инвалидизации и даже смерти. По данным Т.А. Коротковой, которая изучала показатели и факторы, влияющие на минерализацию костной ткани в период роста у 412 подростков 15-18 лет, проживающих в Москве, более чем у половины обследованных подростков был выявлен дефицит витамина D, фофора и кальция. Оказалось, что только 6,3% мальчиков получали 1300 мг кальция в день с пищей, что соответствует рекомендованной возрастной норме, а из девочек ни одна не получала этот микроэлемент в должном количестве.
Следует отметить, что изучению роли кальция, фосфора и витамина D в формировании минеральной плотности кости (МПК) у женщин и мужчин в разные возрастные периоды жизни посвящены многочисленные исследования. Вместе с тем внимание ученых привлекает проблема низкого содержания микроэлементов в организме при различных патологических состояниях, в том числе при остеопорозе , заболеваниях костей и суставов.
Большинство микроэлементов входит в биологически активные соединения или оказывает на них влияние. В составе ферментов, гормонов и иммунных комплексов микроэлементы участвуют в метаболических и иммунных процессах, определяя функциональное состояние различных органов и систем, в том числе костной и хрящевой ткани, их качество и структуру. Больные остеопорозом , как правило страдают одновременно двумя-тремя и более хроническими заболеваниями, которые оказывают негативное влияние на костную ткань. В группу болезней, на фоне которых развивается остеопороз , отнесены ревматоидный артрит, сахарный диабет, целиакия, хроническая почечная недостаточность, хроническая обструктивная болезнь легких и бронхиальная астма, заболевания щитовидной и паращитовидной желез, крови, печени и поджелудочной железы. Прием противосудорожных препаратов, глюкокортикоидов и многих других лекарственных средств также способствует развитию остеопороза .
Ведущую роль в этом процессе играет уровень обеспечение организма не только витаминами и белком, но и макро- и микроэлементами. Дефицит, обусловленный недостаточным потреблением с пищей или пониженным всасыванием этих веществ, может стать причиной снижения минеральной плотности кости. Особое значение придается таким микроэлементам, как медь, цинк, марганец и бору . Медь, марганец и цинк, которые входят в состав ферментов, ответственных за синтез коллагена непосредственно участвуют в синтезе костного матрикса. Кроме того, цинк входит в состав более 300 ферментов, участвует в процессах синтеза и распада углеводов, белков, жиров, нуклеиновых кислот. Недостаточное потребление цинка приводит к анемии, вторичному иммунодефициту, циррозу печени, половой дисфункции, порокам развития плода. Цинк в комплексе с аминокислотой цистеином принципиально важен для метаболизма генов. Инсулин, кортикотропин, соматотропин и гонадотропин являются цинкзависимыми гормонами. Костная ткань содержит основной запас (около 30%) цинка всего организма. Концентрация цинка в костной ткани быстро снижается при недостаточном поступлении цинка в организм или нарушении его усвоения. В связи с этим неудивительно, что дефекты развития костной системы человека обусловлены дефицитом цинка. В среднем человек потребляет от 7,5 до 17,0 мг цинка в сутки, при этом физиологическая потребность в цинке у взрослых составляет 12 мг/сут, а у детей - от 3 до 12 мг/сут. Источниками цинка являются говядина, печень, морепродукты (устрицы, сельдь, моллюски), зерновая завязь, морковь, горох, отруби, овсяная мука, орехи.
Медь входит в состав ферментов, обладающих окислительно- восстановительной активностью и участвующих в метаболизме железа, стимулирует усвоение белков и углеводов, задействована в процессах обеспечения тканей организма человека кислородом. Кроме того, этот микроэлемент необходим для межмолекулярной связи коллагена и эластина. Медь - основной компонент миелиновой оболочки, участвует в образовании коллагена, минерализации скелета, синтезе эритроцитов, образовании пигментов кожи. Клиническими проявлениями недостатка меди в организме служат нарушения формирования и функции сердечно-сосудистой системы, скелета, развитие дисплазии соединительной ткани. Дефицит меди влечет угнетение роста кости и ОП, что наблюдается при синдроме Менкеса (врожденная неспособность усваивать медь). Суточная потребность в меди колеблется от 0,9 до 3,0 мг/сут. При этом физиологическая потребность в меди у взрослых составляет 1,0 мг/сут, у детей - от 0,5 до 1,0 мг/сут.
Источниками меди являются шоколад, какао, печень, орехи, семечки, грибы, моллюски, лосось и шпинат.
Недостаточное поступление в организм марганца сопровождается замедлением роста, нарушениями в репродуктивной системе, повышенной хрупкостью костной ткани, нарушениями углеводного и липидного обмена. Связано это с тем, что марганец принимает непосредственное участие в образовании костной и соединительной ткани, входит в состав ферментов, включающихся в метаболизм аминокислот, углеводов, катехоламинов, необходим для синтеза холестерина и нуклеотидов.
Пищевыми источниками марганца являются зеленые листовые овощи, продукты из неочищенного зерна (пшеницы, риса), орехи и чай. Среднее потребление данного микроэлемента с продуктами питания колеблется от 1 до 10 мг/сут. Установленные уровни потребности варьируют от 2 до 5 мг/сут, а физиологическая потребность у взрослых составляет 2 мг/сут.
Роль бора в процессах остеогенеза определяется непосредственным влиянием данного микроэлемента на метаболизм витамина D, а также регуляцией активности паратиреоидного гормона, который, как известно, ответствен за обмен кальция, фосфора и магния. Это позволяет полагать, что влияние бора на метаболизм костной ткани сопоставимо с таковым витамина D. Суточная потребность в боре составляет 2-3 мг/сут, он содержится в корневых овощах, винограде, грушах, яблоках, орехах и пиве.
Сведения об исследовании статуса микроэлементов при патологии костной системы (остеопения, остеопороз) чрезвычайно ограниченны, так как, к сожалению, проводилось мало исследований, но накопленный материал позволяет сделать однозначные выводы.
Установлена прямая зависимость содержания минералов в костях предплечья с усвоением цинка у женщин в постменопаузе, что свидетельствует о влиянии этого микроэлемента на сохранение костной массы. Другие исследования показали, что усвоение цинка снижается с возрастом, особенно у женщин, и взаимосвязано с потерей костной массы в постменопаузе. Выявлено повышение выделения цинка с мочой у пациенток с остеопорозом по сравнению с женщинами соответствующего возраста без остеопороза , что может быть связано с повышенной резорбцией кости, которая ведет к высвобождению цинка из костной ткани.
Установлено, что концентрация цинка в крови, а также его усвоение у пожилых пациенток с остеопорозом статистически значимо ниже, чем у молодых женщин. Уровень цинка в сыворотке крови у пациенток с постменопаузальным ОП ниже, чем у женщин без остеопороза .
Особый интерес представляет исследование взаимосвязи между показателями статуса цинка в организме и биохимических маркеров ремоделирования кости у европейцев в возрасте 55-87 лет, проведенное в четырех научных центрах Франции, Италии и Северной Ирландии (ZENITH). Исследование продолжалось 6 месяцев, в нем участвовали 387 здоровых мужчин и женщин. Всем пациентам определяли концентрацию цинка в крови и моче, уровень маркеров формирования костной ткани и маркеров резорбции кости. У большинства пациентов ремоделирование кости было в норме, признаки дисбаланса процессов формирования и резорбции кости отсутствовали. После учета искажающих факторов (возраст, пол и исследовательский центр) были получены некоторые данные о взаимосвязи между обменом цинка в организме и ремоделированием кости у здоровых взрослых людей.
Исследование турецких ученых было посвящено изучению содержания магния, цинка и меди в сыворотке крови женщин с постменопаузальным остеопорозом , остеопенией и нормальной минеральной плотности кости шейки бедра. Было установлено, что концентрация магния и цинка у пациенток с остеопорозом значимо ниже, чем у женщин с остеопенией и здоровых женщин, а у женщин с остеопенией - статистически значимо ниже, чем у здоровых. Статистически значимого различия между группами по концентрации меди не выявлено. Авторы высказали мнение, что поступление микроэлементов, в особенности магния, цинка и, вероятно, меди, может оказать благоприятное воздействие на плотность костной ткани. Однако ряд исследователей не обнаружили значимого различия в концентрации магния, цинка, селена и марганца в крови и эритроцитах женщин в постменопаузе как с остеопорозом , так и без остеопороза .
Необходимо отметить, что во многих странах статус магния, меди, цинка, марганца, селена и бора у пациенток с остеопорозом в литературе не описан. Некоторые исследователи сообщают о снижении уровня этих микроэлементов у пациенток с остеопорозом , в то время как другие утверждают обратное. Противоречивость данных об уровне магния, меди, цинка, марганца, селена и бора в плазме крови у пожилых людей объясняется тем, что в качестве показателя используется концентрация этих микроэлементов в плазме или сыворотке крови. Однако данный показатель ненадежен, поскольку подвержен влиянию ряда факторов, не имеющих отношения к содержанию веществ в организме. К числу таких факторов относится прием лекарственных средств гормонозаместительной терапии, диуретиков, слабительных препаратов и др.).
В нашей стране интерес к исследованию связи между остеотропными микроэлементами, характеристикой костной ткани и возможностью использования препаратов, в состав которых входят указанные микроэлементы, для профилактики и лечения остеопороза очевиден.
Так, отечественными педиатрами изучен статус микроэлементов и показателей минеральной плотности кости различных отделов скелета у 100 подростков в возрасте 11-15 лет, госпитализированных по поводу вегетативной дистонии. У обследованных обнаружены изменения в содержании бора, меди, марганца и цинка, а у 46 человек выявлена остеопения. Удалось установить взаимосвязь между содержанием микроэлементов в волосах и минеральной плотностью костей, проанализировать возможность ее оценки на основании определения комплекса указанных микроэлементов.
Таким образом, людям с болезнями костей и суставов необходимо понимать, что для развития остеопороза имеется много причин: сопутствующие заболевания, характер питания, потребление богатых микроэлементами продуктов, признаки дефицита кальция, витамина D, цинка, меди, марганца, селена и бора.
Популяризация знаний о необходимости профилактики и лечения остеопороза , вкладе кальция, витамина D и микроэлементов в здоровье кости позволит снизить частоту переломов, а следовательно, и социально-экономические затраты общества.
В Клинических рекомендациях, подготовленных Российской ассоциацией по остеопорозу, сформулированы положения по лечению и профилактике остеопороза , основанные на анализе большого количества источников с позиций доказательной медицины. Основной задачей профилактики остеопороза является улучшение качества жизни пациентов, предотвращение риска переломов костей скелета. Профилактика остеопороза должна быть направлена на раннюю диагностику и рациональное лечение заболевания. В арсенале терапевтических средств имеются необходимые современные антиостеопоротические препараты. Доказана эффективность различных агентов (препаратов кальция и витамина D в комбинации с остеотропными микроэлементами и др.) при профилактике и лечении остеопороза , установлено их положительное действие на минеральную плотность кости.
По материалам «Эффективная фармакотерапия» №38 2013, Спецвыпуск №2 Остеопороз, Репринт И.С. Дадыкина, П.С. Дадыкина, О.Г. Алексеева «Вклад микроэлементов (меди, марганца, цинка, бора) в здоровье кости: вопросы профилактики и лечения остеопении и остеопороза»
Кость - твёрдый орган живого организма. Состоит из нескольких тканей, важнейшей из которых является костная. Кость выполняет опорно-механическую и защитную функции, является составной частью эндоскелета позвоночных, производит красные и белые кровяные клетки, сохраняет минералы. Костная ткань - одна из разновидностей плотной соединительной ткани.
Кости обладают большим разнообразием форм и размеров, зависящих от функции конкретной кости. Каждая обладает сложной структурой, благодаря чему они достаточно лёгкие, но при этом жёсткие и прочные. Кость может включать в свою структуру: костный мозг, эндост, надкостницу, нервы, кровеносные сосуды, хрящи.
Кости состоят из различных клеток костной ткани: остеобласты участвуют в создании и минерализации костей, остеоциты поддерживают структуру, а остеокласты обеспечивают резорбцию костной ткани. Минерализованная матрица костной ткани имеет органическую составляющую в основном из коллагена и неорганическую составляющую костной ткани из различных солей.
В человеческом теле, при рождении, более 270 костей, но многие из них срастаются в процессе роста, оставляя в общей сложности 206 отдельных костей во взрослом организме (не считая многочисленные мелкие сесамовидные кости). Бедренная кость - самая большая кость в теле человека, самая маленькая - стремя в среднем ухе.
В состав костей входят как органические, так и неорганические вещества; количество первых тем больше, чем моложе организм; в связи с этим кости молодых животных отличаются гибкостью и мягкостью, а кости взрослых - твёрдостью. Отношение между обеими составными частями представляет различие в разных группах позвоночных; так, в кости рыб, особенно глубоководных, содержание минеральных веществ относительно мало, и они отличаются мягким волокнистым строением.
У взрослого человека количество минеральных составных частей (главным образом, гидроксиапатита) составляет около 60-70 % веса кости, а органическое вещество (главным образом коллаген тип I) - 30-40 %. Кости имеют большую прочность и громадное сопротивление сжатию, чрезвычайно долго противостоят разрушению и принадлежат к числу самых распространённых остатков ископаемых животных. При прокаливании кость теряет органическое вещество, но сохраняет свою форму и строение; подвергая кость действию кислоты (например соляной), можно растворить минеральные вещества и получить гибкий органический (коллагеновый) остов кости.
При сжигании кость чернеет с выделением углерода, который остаётся после разложения органических веществ. При дальнейшем выгорании углерода получается белый твёрдый хрупкий остаток.
У пожилых людей в костях увеличивается доля минеральных веществ, из-за этого их кости становятся более хрупкими (остеопороз).
Микроскопическая структура кости
По микроскопическому строению костное вещество представляет особый вид соединительной ткани (в широком смысле слова), костную ткань, характерные признаки которой: твёрдое, пропитанное минеральными солями волокнистое межклеточное вещество и звездчатые, снабжённые многочисленными отростками, клетки.
Основу кости составляют коллагеновые волокна, окруженные кристаллами гидроксиапатита, которые слагаются в пластинки. Пластинки эти в костном веществе частью располагаются концентрическими слоями вокруг длинных разветвляющихся каналов (Гаверсовы каналы), частью лежат между этими системами, частью обхватывают целые группы их или тянутся вдоль поверхности кости. Гаверсов канал в сочетании с окружающими его концентрическими костными пластинками считается структурной единицей компактного вещества кости - остеоном. Параллельно поверхности этих пластинок в них расположены слои маленьких звездообразных пустот, продолжающихся в многочисленные тонкие канальцы - это так называемые «костные тельца», в которых находятся костные клетки, дающие отростки в канальцы. Канальцы костных телец соединяются между собой и с полостью Гаверсовых каналов, внутренними полостями и надкостницей, и таким образом вся костная ткань оказывается пронизанной непрерывной системой наполненных клетками и их отростками полостей и канальцев, по которым и проникают необходимые для жизни кости питательные вещества. По Гаверсовым каналам проходят тонкие кровеносные сосуды (обычно артерия и вена); стенка Гаверсова канала и наружная поверхность кровеносных сосудов одеты тонким слоем эндотелия, а промежутки между ними служат лимфатическими путями кости. Губчатое костное вещество не имеет Гаверсовых каналов.
Костная ткань рыб представляет некоторые отличия: Гаверсовых каналов здесь нет, а канальцы костных телец сильно развиты.
Остеобласты - молодые остеобразующие клетки костей (диаметр 15-20 мкм), которые синтезируют межклеточное вещество - матрикс. По мере накопления межклеточного вещества остеобласты замуровываются в нём и становятся остеоцитами. Родоначальником являются адвентициальные клетки.
Остеоциты - клетки костной ткани позвоночных животных и человека, значительно или полностью утратившие способность синтезировать органический компонент матрикса.
Они имеют отростчатую форму, округлое плотное ядро и слабобазофильную цитоплазму. Органоидов мало, клеточного центра нет - клетки утратили способность к делению. Они располагаются в костных полостях, или лакунах, повторяющих контуры остеоцита, и имеют длину 22-25 мкм, а ширину 6-14 мкм. Во все стороны от лакун отходят слегка ветвящиеся канальцы костных полостей, анастомозирующие (сообщающиеся) между собой и с периваскулярными пространствами сосудов, идущих внутри кости. В пространстве между отростками остеоцитов и стенками канальцев содержится тканевая жидкость, движению которой способствуют «пульсирующие» колебания остеоцитов и их отростков. Остеоциты - единственная живая и активно функционирующая клетка в зрелой костной ткани, их роль заключается в стабилизации органического и минерального состава кости, обмене веществ (в том числе в транспортировке ионов Са из кости в кровь и обратно). Костная ткань, не содержащая живых остеоцитов, быстро разрушается.
Клетки гематогенного происхождения, образующиеся из моноцитов. Может содержать от 2 до 50 ядер. Организация остеокласта адаптирована к разрушению кости. В сочетании с остеобластами, остеокласты контролируют количество костной ткани (остеобласты создают новую костную ткань, а остеокласты разрушают старую)
Принципиальная схема строения трубчатой кости
В скелете человека различают по форме длинные, короткие, плоские и смешанные кости, также есть кости пневматические и сесамовидные. Расположение костей в скелете связано с выполняемой ими функцией: «Кости построены так, что при наименьшей затрате материала обладают наибольшей крепостью, легкостью, по возможности уменьшая влияние толчков и сотрясений» (П. Ф. Лесгафт).
Длинные кости, ossa longa, имеют вытянутую, трубчатую среднюю часть, называемую диафизом , diaphysis, состоящую из компактного вещества. Внутри диафиза имеется костномозговая полость , cavitas medullaris, с жёлтым костным мозгом. На каждом конце длинной кости находится эпифиз , epiphysis, заполненный губчатым веществом с красным костным мозгом. Между диафизом и эпифизом располагается метафиз , metaphysis. В период роста кости здесь находится хрящ, который позже окостеневает. Длинные трубчатые кости составляют в основном скелет конечностей. Костные выступы на эпифизах, которые являются местом прикрепления мышц и связок, называются апофизами (apophysis).
Плоские кости , ossa plana, состоят из тонкого слоя губчатого вещества, покрытого снаружи компактным веществом. Они различны по происхождению: лопатка и тазовая кость развиваются из хряща, а плоские кости крыши черепа - из соединительной ткани.
Короткие кости , ossa brevia, состоят из губчатого вещества, покрытого снаружи тонким слоем компактного вещества. Одной большой костно-мозговой полости эти кости не имеют. Красный костный мозг располагается в мелких губчатых ячейках, разделённых костными балками. Короткие кости запястья и предплюсны способствуют большей подвижности кистей и стоп.
Смешанные кости , ossa irregularia, находятся в различных отделах скелета (позвоночник, череп). В них сочетаются элементы коротких и плоских костей (основная часть и чешуя затылочной кости, тело позвонка и его отростки, каменистая часть и чешуя височной кости). Такие особенности обусловлены различием происхождения и функции частей этих костей.
Пневматические кости , или воздухоносные, - кости, которые имеют внутри полость, выстланную слизистой оболочкой и заполненную воздухом, что облегчает вес кости, не уменьшая её прочности.
Сесамовидные кости - это кости, вставленные в сухожилия мышц и поэтому увеличивающие плечо силы мышц, способствующие усилению их действия.
Поверхность кости может иметь различные углубления (бороздки, ямки и т. д.) и возвышения (углы, края, ребра, гребни, бугорки и т. п.). Неровности служат для соединения костей между собой или для прикрепления мускулов и бывают тем сильнее развиты, чем более развита мускулатура. На поверхности находятся так называемые «питательные отверстия» (Foramina nutricia), через которые входят внутрь кости нервы и кровеносные сосуды.
В костях различают компактное и губчатое костное вещество. Первое отличается однородностью, твёрдостью и составляет наружный слой кости; оно особенно развито в средней части трубчатых костей и утончается к концам; в широких костях оно составляет 2 пластинки, разделённые слоем губчатого вещества; в коротких оно в виде тонкой плёнки одевает кость снаружи. Губчатое вещество состоит из пластинок, пересекающихся в различных направлениях, образуя систему полостей и отверстий, которые в середине длинных костей сливаются в большую полость.
Наружная поверхность кости одета так называемой надкостницей (Periosteum), оболочкой из соединительной ткани, содержащей кровеносные сосуды и особые клеточные элементы, служащие для питания, роста и восстановления кости.
Внутренние полости кости содержат мягкую, нежную, богатую клетками и снабжённую кровеносными сосудами массу, называемую костным мозгом (у птиц часть полостей наполнена воздухом). Различают три его вида: слизистый (желатинозный), красный (или часто - миелоидный), и жёлтый или жировой (наиболее распространённый). Основную форму составляет красный костный мозг, в нём наблюдается нежная соединительно-тканная основа, богатая сосудами, очень похожие на лейкоциты костномозговые или лимфатические клетки, клетки, окрашенные гемоглобином и считаемые за переход к красным кровяным тельцам, бесцветные клетки, содержащие внутри красные шарики, и многоядерные крупные («гигантские») клетки, так называемые миэлопласты.
Красный (деятельный) костный мозг - это миелоидная ткань , которая, как и лимфоидная, состоит из двух основных компонентов: стромального - строма, служащая микроокружением для гемопоэтических (кроветворных) клеток, и гемального - форменные элементы крови на разных стадиях развития.
Строма образована ретикулярной тканью, остеогенными, тучными, жировыми, адвентициальными, эндотелиальными клетками и межклеточным веществом.
Желтый (недеятельный) костный мозг - это жировая ткань с отдельными островками (стромами) ретикулярной ткани. Он находится в костномозговых каналах трубчатых костей и в частях ячеек губчатого вещества костей.
Слизистый костный мозг - студенистая, слизистая, бедная клетками консистенция. Он образуется в развивающихся костях черепа и лица.
При отложении в стромальный компонент основы жира и уменьшении числа миелоидных элементов красный мозг переходит в жёлтый, а при исчезновении жира и миелоидных элементов он приближается к слизистому.
Костный мозг не имеет ничего общего с головным и спинным мозгом. Он не относится к нервной системе и не имеет нейронов.
Костный мозг является важнейшим кроветворным органом.
Развитие кости происходит двумя способами:
- из соединительной ткани;
- на месте хряща.
Из соединительной ткани развиваются кости свода и боковых отделов черепа, нижняя челюсть и, по мнению некоторых, ключица (а у низших позвоночных и некоторые другие) - это так называемые покровные или облегающие кости. Они развиваются прямо из соединительной ткани; волокна её несколько сгущаются, между ними появляются костные клетки и в промежутках между последними отлагаются известковые соли; образуются сначала островки костной ткани, которые затем сливаются между собой. Большинство костей скелета развивается из хрящевой основы, имеющей такую же форму, как будущая кость. Хрящевая ткань подвергается процессу разрушения, всасывания и вместо неё образуется, при деятельном участии особого слоя образовательных клеток (остеобластов), костная ткань; процесс этот может идти как с поверхности хряща, от одевающей его оболочки, перихондрия, превращающегося затем в надкостницу, так и внутри его. Обыкновенно развитие костной ткани начинается в нескольких точках, в трубчатых костях отдельными точками окостенения обладают эпифизы и диафиз.
Рост кости в длину происходит главным образом в частях ещё не окостеневших (в трубчатых костях между эпифизами и диафизом), но отчасти и путём отложения новых частиц ткани между существующими («интуссусцепция»), что доказывают повторные измерения расстояний между вбитыми в кость остриями, питательными отверстиями и т. п.; утолщение костей происходит путём отложения на поверхности кости новых слоев («аппозиция»), благодаря деятельности остеобластов надкостницы. Эта последняя обладает в высокой степени способностью воспроизводить разрушенные и удалённые части кости. Деятельностью её обусловливается и срастание переломов. Параллельно с ростом кости идёт разрушение, всасывание (резорбция) некоторых участков костной ткани, причём деятельную роль играют так называемые остеокласты («клетки, разрушающие кость»).
Синдесмология - учение о соединениях костей.
- Синартрозы - непрерывные соединения костей, более ранние по развитию, неподвижные или малоподвижные по функции.
- Синдесмоз - кости соединены посредством соединительной ткани.
- межкостные перепонки (между костями предплечья или голени)
- связки (во всех суставах)
- роднички
- швы
- зубчатые (большинство костей свода черепа)
- чешуйчатые (между краями височной и теменной костей)
- гладкие (между костями лицевого черепа)
- Синхондроз - кости соединены посредством хрящевой ткани. по свойству хрящевой ткани:
- гиалиновый (между рёбрами и грудиной)
- волокнистые (между позвонками)
по длительности своего существования различают синхондрозы:
- временные
- постоянные
- Синостоз - кости соединены посредством костной ткани.
- Синдесмоз - кости соединены посредством соединительной ткани.
- Диартрозы - прерывные соединения, более поздние по развитию и более подвижные по функции. классификации суставов:
- по числу суставных поверхностей
- по форме и по функции
- Гемиартроз - переходная форма от непрерывных к прерывным или обратно.
Каждому необходимо знать скелет человека с названием костей. Это важно не только врачам, но и обычным людям, ведь информация о строении человека, его скелете и мышцах поможет его укреплять, чувствовать себя здоровым, а в какой-то момент могут выручить в экстренных ситуациях.
Скелет и мышцы вместе составляют локомоторную систему человека. Скелет человека - целый комплекс костей разных типов и хрящей, взаимосвязанных с помощью непрерывных соединений, синартрозов, симфизов. Кости по составу делят на:
- трубчатые, формирующие верхние (плечо, предплечье) и нижние (бедро, голень) конечности;
- губчатые, стопа (в частности, предплюсны) и кисть человека (запястья);
- смешанные - позвонки, крестец;
- плоские, сюда относят тазовые и черепные кости.
Важно! Костная ткань, несмотря на свою повышенную прочность, способна расти и восстанавливаться. В ней происходят метаболические процессы, а в красном костном мозге даже формируются клетки крови. С возрастом костная ткань перестраивается, становится способной адаптироваться к различным нагрузкам.
Виды костей
Сколько костей в теле человека?
Строение скелета человека претерпевает множество изменений на продолжении всей жизни. На начальном этапе развития плод состоит из хрупкой хрящевой ткани, которая со временем постепенно замещается на костную. Новорожденный ребёнок имеет более 270 мелких костей. С возрастом некоторые из них могут срастаться, к примеру, черепные и тазовые, а также некоторые позвонки.
Сказать сколько точно костей в теле у взрослого человека очень сложно. Иногда у людей встречаются дополнительные рёбра или кости в стопе. Могут быть наросты на пальцах, чуть меньшее или большее количество позвонков в любом из отделов позвоночника. Строение скелета человека сугубо индивидуально. В среднем у взрослого человека насчитывают от 200 до 208 костей .
Каждый отдел выполняет свои узкоспециализированные задачи, однако скелет человека в целом обладает несколькими общими функциями:
- Опорная. Осевой скелет является опорой для всех мягких тканей тела и системой рычагов для мышц.
- Двигательная. Подвижные сочленения между костями позволяют человеку совершать миллионы точных движений с помощью мышц, сухожилий, связок.
- Защитная. Осевой скелет защищает мозг и внутренние органы от травм, выступает в роли амортизатора при ударах.
- Метаболическая. В состав костной ткани входит большое количество фосфора, кальция и железа, участвующих в обмене минералами.
- Кроветворная. Красный мозг трубчатых костей является местом, где проходит гемопоэз - образование эритроцитов (красных кровяных телец) и лейкоцитов (клеток иммунной системы).
Если нарушены некоторые функции скелета, могут возникнуть заболевания разной степени тяжести.
Функции скелета человека
Отделы скелета
Скелет человека делят два больших отдела: осевой (центральный) и добавочный (или скелет конечностей). Каждый из отделов выполняет свои задачи. Осевой скелет защищает полостные органы от повреждений. Скелет верхней конечности соединяет руку с туловищем. За счёт повышенной подвижности костей руки, он помогает выполнять множество точных движений пальцами. Функции скелета нижних конечностей заключаются в связывании ноги с туловищем, передвижении тела, амортизации при ходьбе.
Осевой скелет. Этот отдел составляет основу организма. В него входят: скелет головы и туловища.
Скелет головы. Черепные кости плоские, неподвижно соединённые (за исключением подвижной нижней челюсти). Они защищают от сотрясений мозг и органы чувств (слуха, зрения и обоняния). Череп делится на лицевой (висцеральный), мозговой и отдел среднего уха.
Скелет туловища . Кости грудной клетки. По внешнему виду этот подотдел напоминает сжатый усечённый конус или пирамиду. Грудная клетка включает в себя парные рёбра (из 12 только 7 сочленены с грудиной), позвонки грудного отдела позвоночника и грудину - непарную грудную кость.
В зависимости от соединения рёбер с грудиной различают истинные (верхние 7 пар), ложные (следующие 3 пары), плавающие (последние 2 пары). Сама грудина считается центральной костью, входящей в осевой скелет.
В ней выделяют тело, верхнюю часть - рукоятку, и нижнюю часть - мечевидный отросток. Кости грудной клетки имеют соединение повышенной прочности с позвонками. На каждом позвонке есть специальная суставная ямка предназначенная для крепления к рёбрам. Такой способ сочленения необходим для выполнения основной функции скелета туловища - защиты органов жизнеобеспечения человека: сердца, лёгких, части пищеварительной системы.
Важно! Кости грудной клетки подвержены внешним влияниям, склонны к видоизменениям. Физическая активность и правильная посадка за столом способствуют правильному развитию грудной клетки. Малоподвижный образ жизни и сутулость приводят к зажатости органов грудной клетки и сколиозу. Неправильно развитый скелет грозит серьёзными проблемами со здоровьем.
Позвоночник. Отдел является центральной осью и основной опорой всего человеческого скелета. Позвоночный столб сформирован из 32-34 отдельных позвонков, защищающих спинномозговой канал с нервами. Первые 7 позвонков называются шейными, следующие 12 – грудными, затем идут поясничные (5), 5 сросшихся, образующих крестец, и 2-5 последних, составляющих копчик.
Позвоночник поддерживает спину и туловище, обеспечивает за счёт спинномозговых нервов двигательную активность всего организма и связь нижней части тела с головным мозгом. Позвонки соединены друг с другом полуподвижно (помимо крестцовых). Такое соединение осуществляется посредством межпозвоночных дисков. Эти хрящевые образования смягчают толчки и сотрясения при любом движении человека и обеспечивают гибкость позвоночника.
Скелет верхней конечности. Скелет верхней конечности представлен плечевым поясом и скелетом свободной конечности. Плечевой пояс обеспечивает соединение руки с корпусом и включает в себя две парные кости:
- Ключицу, которая обладает S-образным изгибом. Одним концом она крепится к грудине, а другим соединена с лопаткой.
- Лопатку. По внешнему виду представляет собой треугольник, прилегающий к туловищу сзади.
Скелет свободной конечности (руки) более подвижен, так как кости в нём соединяются крупными суставами (плечевым, лучезапястными локтевым). Скелет представлен тремя подотделами:
- Плечом, которое состоит из одной длинной трубчатой кости - плечевой. Одним из своих концов (эпифизов) она крепится к лопатке, а другим, переходящим в мыщелок, к предплечным костям.
- Предплечьем: (двумя костями) локтевая, расположенная на одной линии с мизинцем и лучевая – на линии с первым пальцем. Обе кости на нижних эпифизах образуют лучезапястное сочленение с запястными костями.
- Кистью, включающей в себя три части: кости запястья, пястья и пальцевые фаланги. Запястье представлено двумя рядами по четыре губчатые кости в каждом. Первый ряд (гороховидная, трёхгранная, полулунная, ладьевидная) служит для прикрепления к предплечью. Во втором ряду находятся крючковидная, трапеция, головчатая и трапецевидная кости, обращённые в сторону ладони. Пясть состоит из пяти трубчатых костей, своей проксимальной частью они неподвижно соединены с запястьем. Кости пальцев. Каждый палец представляет собой три соединённых друг с другом фаланги, помимо большого пальца, который противопоставлен остальным, и имеет всего две фаланги.
Скелет нижней конечности. Скелет ноги, так же как и рука, состоит из пояса конечности и её свободной части.
Скелет конечностей
Пояс нижних конечностей сформирован парными костями таза. Они срастаются из парных лобковых, подвздошных и седалищных костей. Это происходит к 15-17 годам, когда хрящевое соединение замещается на неподвижное костное. Подобное прочное сочленение необходимо для поддержания органов. Три кости слева и справа от оси тела, образуют по вертлужной впадине, необходимой для сочленения таза с головкой бедренной кости.
Кости свободной нижней конечности подразделяются на:
- Бедренную. Проксимальным (верхним) эпифизом она соединяется с тазом, а дистальным (нижним) с большой берцовой костью.
- Надколенник (или коленная чашечка) прикрывает сустав колена, образованный в месте соединения бедренной и большой берцовой костей.
- Голень представлена большой берцовой костью, расположенной ближе к тазу, и малой берцовой.
- Кости стопы. Предплюсна представлена семью костями, составляющими 2 ряда. Одной из самых крупных и хорошо развитых является пяточная кость. Плюсна является средним отделом стопы, количество костей входящих в неё равно числу пальцев. Они соединены с фалангами при помощи суставов. Пальцы. Каждый палец состоит из 3-х фаланг, кроме первого, у которого их две.
Важно! В течение жизни стопа подвержена видоизменениям, на ней могут образовываться мозоли и наросты, возможен риск развития плоскостопия. Часто это связано с неправильным выбором обуви.
Строение женщины и мужчины не имеет кардинальных различий . Изменениям подвергаются лишь отдельные части некоторых костей или их размеры. Среди наиболее явных выделяют более узкую грудь и широкий таз у женщины, что связано с родовой деятельностью. Кости мужчин, как правило, длиннее, мощнее женских, имеют больше следов крепления мышц. Отличить женский череп от мужского намного сложнее. Череп мужчин чуть толще женского, у него сильнее выражен контур надбровных дуг и затылочный бугор.
Анатомия Человека. Кости скелета!
Из каких костей состоит скелет человека, детальный рассказ
Строение человека отличается чрезвычайной сложностью, однако минимальный объём информации о функциях скелета, росте костей и их расположение в теле, может помочь в сохранении собственного здоровья.
В молодости мы мало задумываемся о своем здоровье. Вспоминаем о нем, когда часто бывает уже поздно — состояние наших костей и суставов претерпело патологические изменения. Чтобы на долгие годы сохранить здоровье и работоспособность, радость движения, необходимо проводить профилактические мероприятия по укреплению костей и суставов. И, прежде всего, обеспечить им полноценное минеральное питание.
Состав костно-хрящевой ткани
Состав костной ткани
Кость представляет собой плотную специализированную соединительную ткань. Кость взрослого человека на 60-70% веса состоит из минеральных веществ: главным образом из фосфата кальция, в значительно меньших количествах присутствуют фосфат магния, фтористый кальций, углекислый и хлористый натрий. Важнейшей органической составляющей костной ткани являются коллаген (I-го типа) и протеогликаны.
Среди клеток костной ткани различают:
остеобласты — клетки, формирующие кость;
остеокласты — клетки, разрушающие кость;
остеоциты — клетки, поддерживающие нужный уровень кальцификации ткани и активирующие остеобласты и остеокласты.
Состав хрящевой ткани
Кости составляют опору нашего тела. Они двигаются друг относительно друга благодаря суставам. Поверхность кости, образующая сустав, покрыта слоем хрящевой ткани. Хрящ выполняет роль амортизатора, уменьшая давление на сочленяющиеся поверхности костей и обеспечивая их плавное скольжение друг относительно друга. Хрящ состоит из специальных хрящевых клеток. Особое строение делает хрящ похожим на губку — в спокойном состоянии он впитывает жидкость, а при нагрузке выдавливает ее в суставную полость, обеспечивая как бы дополнительную «смазку» сустава.
Хрящевая ткань не имеет собственных сосудов. Питание хрящ получает из суставной жидкости и из подлежащих под ним костных структур путем диффузии. При нарушении питания (например, из-за малоподвижности) хрящевая ткань недополучает необходимых ей для нормального синтеза и функционирования веществ (в том числе витаминов и минералов), нарушается ее структура. Хрящ размягчается, разрыхляется, в нем появляются трещины. Развивается артроз.
Изменение костной ткани в различные возрастные периоды
Кость — это живая ткань, пронизанная кровеносными сосудами и нервными окончаниями, активно участвующая в обменных процессах организма. Это постоянно развивающаяся и обновляющаяся система, в ней непрерывно идут процессы синтеза и распада. За счет активности костеобразующих клеток, остеобластов, и клеток, разрушающих костную ткань, остеокластов, кальций и другие минералы постоянно откладываются и вновь вымываются из кости. В молодости преобладают процессы синтеза. Происходит наращивание костной массы, ее интенсивная минерализация. Своей максимальной величины минерализация костной ткани достигает к 25-30 годам. А затем плотность костной ткани начинает постепенно снижаться. После 40 лет убыль костной ткани достигает 1% в год у женщин и 0,5% у мужчин. Это естественный процесс, связанный с постепенным старением организма и возрастным снижением скорости обменных процессов. Снижение минеральной плотности костной ткани у здоровых, физически активных людей протекает очень медленно и малозаметно. Но некоторые неблагоприятные факторы могут резко ускорить этот процесс и привести к преждевременному старению костно-хрящевой ткани и развитию ряда дегенеративных заболеваний.
Причины снижения минеральной плотности костной ткани
:
Недостаток поступления минералов в организм
Кальций — основной минеральный компонент костной ткани. Организм получает его с пищей. Лучшим источником усвояемого кальция служат молоко и молочные продукты (особенно твердые сыры). 0,5 л молока или 100 г сыра гарантированно удовлетворяют суточную потребность в кальции. Кальций злаковых, хлебных продуктов усваивается в меньшей степени в связи с неблагоприятным его соотношением в этих продуктах с фосфором и магнием, а также в связи с наличием в злаковых инозит-фосфорной кислоты, образующей с фосфором неусвояемые соединения. Если питание человека неполноценно, например, он сидит на диете, страдает непереносимостью молочных продуктов, то поступление кальция в организм становится недостаточным и возникает дефицит. Чаще всего недостаток кальция в нашем организме 2-10%.
Но даже если наша пища содержит достаточно кальция, человек все равно может испытывать дефицит этого минерала вследствие плохого усвоения кальция в кишечнике. Причины этого могут быть различны:
Малодоступная форма минерала — в составе пищевых продуктов кальций находится в виде плохо растворимых в воде соединений.
Недостаток витамина D — витамин D регулирует синтез в желудочно-кишечном тракте белка-переносчика кальция, с помощью которого происходит усвоение этого элемента.
Наличие микроэлементов-антагонистов — ионы кальция конкурируют за одни и те же рецепторы всасывания кишечных клеток с такими минеральными элементами как железо. При совместном поступлении в желудочно-кишечный тракт в результате антагонистической борьбы количество усвоенных элементов резко снижается.
Наличие в пище веществ, препятствующих всасыванию кальция — это такие вещества как алкоголь, большое количества жиров, сахара, фитиновых кислот (содержатся в зернах злаковых культур, семенах, орехах, овощах). Эти вещества связывают кальций, делая его недоступным для усвоения.
Магний является составной частью костной ткани. Между ионами кальция и магния существует тесная функциональная взаимосвязь. Она прослеживается как на уровне всасывания в кишечнике, так и на уровне дальнейшего метаболизма обоих ионов.
При дефиците магния активность витамина Д значительно снижается, в результате чего снижается обеспеченность организма кальцием вплоть до клинически выраженного дефицита.
Калий является одним из главных компонентов пищи, препятствующих деминерализации костей. Помимо этого, калий способствует всасыванию кальция в почках и тем самым значительно снижает его выведение из организма с мочой.
Марганец
Ионы марганца регулируют активность ферментов, участвующих в синтезе коллагена и протеогликанов (гликозаминогликанов), входящих в состав матрикса костной ткани и составляющих основу хрящевой ткани. Именно поэтому при дефиците марганца резко снижается активность синтетических процессов и восстановление хрящевой ткани.
Медь участвует в синтезе коллагена и образовании соединительнотканного каркаса костной и хрящевой ткани. Дефицит меди может привести к разрежению костной ткани вплоть до остеопороза и дегенеративным изменениям суставов.
В метаболизме хрящевой ткани и ее компонентов огромную роль играют атомы серы. Перенос серных остатков на молекулы гликозаминогликанов осуществляется ферментом, в состав которого входит атом селена.
Цинк входит в состав более чем 200 металлоферментов, участвующих в самых различных обменных процессах организма, в том числе связанных с синтезом и функционированием костно-хрящевой ткани. При его дефиците резко замедляется формирование скелета и окостенение хрящей. Дефицит цинка является одним из факторов риска развития остеопороза.
Наибольшее содержание бора отмечено в костной ткани. Бор регулирует активность паратгормона щитовидной железы, а соответственно и метаболизм кальция, фтора и магния — основных минералов костной ткани. Бор влияет на метаболизм витамина D, регулирующего усвоение кальция организмом. Бор стимулирует синтез стероидных гормонов — тестостерона и эстрогена, оказывающих защитное действие на костную ткань. Это особенно актуально для женщин постклимактерического возраста, когда резко возрастает риск возникновения остеопороза.
Кремний (в составе бамбука)
Кремний необходим для синтеза коллагена и гликозоаминогликанов, составляющих основу матрикса костно-хрящевой ткани. Также он принимает участие в минерализации костей. Играет значительную роль в восстановлении костной ткани. При переломах костей наш организм увеличивает содержание кремния в костях в 50 раз по сравнению с обычным состоянием. Как только кости срастутся, уровень кремния приходит в норму.
Йод (в составе ламинарии)
Йод участвует в процессах роста и размножения клеток костно-хрящевой системы, обеспечивает их нормальный рост.
Фтор (в составе ламинарии)
Фтор входит в состав костной ткани, принимает активное участие в обмене кальция и фосфора. Фторид кальция обеспечивает прочность костей и зубов, предотвращает дестабилизацию скелета, остеопороз, переломы. Соотношение «кальций-фтор» должно составлять 1:1,5-2.
Хром укрепляет костную ткань и способствует профилактике остеопороза. В больших количествах накапливается в костях и костном мозге.
Молибден
Молибден задерживает в организме фтор, что ведет к укреплению костной ткани и препятствует развитию кариеса зубов.
Молибден снижает интенсивность образования и накопления мочевой кислоты в тканях, а также в синовиальных оболочках суставов, что предупреждает развитие подагры.
Ванадий способствует правильному накоплению солей кальция в костях, участвует в формировании зубов, повышает их устойчивость к кариесу. Достаточный уровень ванадия в организме предотвращает деформации опорно-двигательного аппарата, а у детей — способствует росту скелета.
Нарушение соотношения кальция с фосфором и магнием
Как уже упоминалось, минеральная основа кости состоит из фосфата кальция. Соотношение между обоими минералами во многом определяет эффективность метаболизма кальция в костной ткани и в организме в целом. Для поддержания оптимальной структуры костной ткани соотношение между кальцием и фосфором в пище должно сохраняться на уровне 1:1,2 — 1:1,8. При избытке кальция в кишечнике происходит образование нерастворимых кальций-фосфорных солей, выводящихся из организма естественным путем. Именно поэтому прием больших доз кальция в составе пищевых добавок без учета количества фосфора, содержащегося в пище, может не достигать желаемого результата. С другой стороны, при избытке фосфора в пище он в большом количестве поступает в кровь и связывается там с ионами кальция с образованием большого количества фосфатов кальция, которые быстро выводятся из организма через почки. В результате этого может даже развиваться клинически выраженный дефицит кальция. Это происходит, например, при употреблении сладких газированных напитков типа Cola или Sprite, содержащих огромное количество фосфорной кислоты. О способности фосфорной кислоты вымывать кальций из костей видно из простого опыта. Если поместить обыкновенный зуб в газировку, то через некоторое время зубная ткань не только размягчится, но и начнет растворяться.
Оптимальное соотношение кальция и магния в организме 1:0,7. Эта же пропорция должна сохраняться и при поступлении этих элементов с пищей. Недостаток магния в пище значительно снижает биодоступность кальция.
Недостаток витаминов D, С, К
Витамин D3 (холекальциферол)
Относится к группе жирорастворимых витаминов. Образуется в коже под воздействием ультрафиолетовых лучей солнечного света. Играет ключевую роль в регуляции роста, обновлении костной ткани. Витамин D регулирует:
всасывание кальция и фосфора в кишечнике;
повторное всасывание ионов кальция и фосфора в почках;
минерализацию костной ткани;
созревание белка коллагена.
Чаще всего витамин D находится в дефиците:
Интенсивность его синтеза организмом резко снижена у жителей северных широт в связи с недостатком солнечного света.
С возрастом снижается чувствительность кишечных рецепторов к витамину D и, соответственно, уровень его поступления в организм.
Основными источниками витамина D являются продукты животного происхождения (сливочное масло, яйца, печень). В рационе некоторых людей их бывает недостаточно. Например, лица с высоким риском атеросклероза и с нарушениями жирового обмена вынуждены ограничивать потребление этих продуктов.
Витамин С (аскорбил пальмитат, в составе шиповника)
Витамин С является составной частью ферментов, участвующих в синтезе белков коллагенов, структурных компонентов органического матрикса костной и хрящевой ткани. При выраженном дефиците витамина С закономерными симптомами являются остеопороз, артроз, костные переломы. Даже незначительный дефицит витамина С проявляется снижением минеральной плотности костной ткани.
Витамин К (в составе экстракта шиповника)
Витамин К необходим для формирования основного неколлагенового белка костной ткани — остеокальцина. Этот белок связывается с ионами кальция в молекулах гидроксиапатита, составляющих минеральную основу кости, и «сшивает» их между собой. Витамин К способен увеличивать всасывание кальция в почках, уменьшая его выведение с мочой, а также блокировать рассасывающее действие на костную ткань некоторых воспалительных факторов.
Снижение уровня половых гормонов
Минеральная плотность костной ткани находится под контролем половых гормонов — эстрогенов и тестостеронов. Их рецепторы располагаются на поверхности костных клеток. Эстрогены поддерживают равновесие между клетками-разрушителями и клетками-строителями. Кроме того, они препятствуют рассасыванию костной ткани и повышению ломкости костей. Мужской гормон тестостерон усиливает развитие костно-мышечной системы за счет стимулирования выработки белка в этих тканях. Тестостерон играет ключевую роль в сохранении здоровых костей у мужчин.
С возрастом происходит постепенное снижение уровня половых гормонов в организме как женщин, так и мужчин. Но в женском организме эти изменения носят более выраженный характер. После 40 лет у женщин уменьшается число женских половых гормонов, регулируемое бором, марганцем и медью. Из-за гормональной перестройки нарушается метаболизм кальция и других минералов. Многие женщины в этот период чувствуют слабость: они разбиты, им тяжело утром встать, а в чем дело, непонятно. Часто причина их недомогания — именно в изменении минерального обмена.
В результате снижения уровня половых гормонов может наступить дисбаланс в минеральном обмене. Общеизвестно, что гормональные изменения, происходящие в организме женщин в период климакса, сопровождаются резким изменением плотности костной ткани. Уже в первые три года после начала менопаузы у четверти женщин снижение костной массы достигает 10-15% в год. Примерно у такого же количества женщин костная масса снижается в год на 1-2%. Возникающий с возрастом недостаток эстрогенов приводит к усилению деятельности остеокластов, выводящих кальций из костей. При этом активность «строительных» клеток остеобластов не увеличивается. Кроме того, при недостатке половых гормонов минералы, поступающие с едой, хуже всасываются в кишечнике. Все это приводит к снижению минеральной плотности костной ткани и в дальнейшем к развитию патологической деминерализации костей — остеопорозу.
Сходные процессы происходят и в организме мужчин. Количество тестостерона, вырабатываемого мужским организмом, начинает снижаться уже с 30-35 лет. В результате, к 45-55 годам содержание тестостерона может составлять лишь около половины от его количества в молодом возрасте. Снижение это постепенное, всего лишь на 1-2% в год, но со временем приводит к ряду изменений, в том числе и к снижению минеральной плотности костной ткани.
Падение уровня тестостерона у мужчин может произойти не только в силу возрастных причин. Способствует этому процессу ожирение. Жировые клетки активно захватывают тестостерон из крови, снижая его уровень.
Нарушение кислотно-щелочного равновесия
Для нормальной жизнедеятельности организма требуется постоянство внутренней среды и, прежде всего, кислотно-щелочного равновесия. Характер питания и преобладание в нем кислотных или щелочных соединений влияют на этот баланс. При его сдвиге в сторону закисления (например, при избыточном потреблении с пищей животных белков), происходит переход ионов кальция из костной ткани в кровь с последующим выведением их из организма. В результате наступает деминерализация (разрежение) костной ткани.
Современный стиль жизни подвергает организм чрезмерному окислению. Основным фактором, сдвигающим кислотно-щелочное равновесие в кислую сторону, является питание. К сожалению, в нашем традиционном рационе преобладают продукты кислотного характера (мясо, рыба, яйца, крупы, хлеб), особенно в зимний период, когда потребление свежих овощей и фруктов резко снижено. Однако не только пища приводит к окислению организма. Повседневные стрессы, активное использование медикаментов, злоупотребление конфетами, кофе, газированными напитками, рафинированной едой, алкоголем, курение, отсутствие физических упражнений могут значительно увеличить степень окисления организма. Сдвиг кислотно-щелочного равновесия в кислую сторону ухудшает общее состояние организма, снижает иммунитет, создает условия для развития различных заболеваний.
Приблизительно определить уровень рН крови можно простым способом. Оттяните нижнее веко и посмотрите на цвет конъюнктивы. В норме она должна быть ярко розовой (рН крови слабо-щелочная). Бледный, светло-розовый цвет свидетельствует о неблагополучии и закислении организма. В достаточно редких случаях сдвига рН крови в щелочную сторону конъюнктива ярко красная. Чтобы привести организм в норму следует употреблять побольше ощелачивающих продуктов, богатых кальцием, магнием и калием (сырые овощи, фрукты, ягоды, молоко и молочные продукты), либо принимать эти минералы в виде пищевых добавок.
Малоподвижный образ жизни
Одной из главных причин снижения минеральной плотности костной ткани является малоподвижный образ жизни. Давно установлено, что длительная неподвижность приводит к развитию остеопороза. Человек, прикованный к постели, теряет около 1% костной массы в неделю, однако возобновление обычной физической активности постепенно восстанавливает нормальное состояние костей.
Движение является основным фактором, предопределяющим плотность и прочность костей. Именно поэтому люди, занимающиеся спортом и ведущие активный образ жизни, гораздо меньше подвержены остеопорозу, чем те, кого трудно сдвинуть с места. Именно повышение комфортности жизни и уменьшение необходимого объема физической нагрузки в современной деятельности человека привело к тому, что в конце ХХ и начале ХХI века развитие остеопороза среди жителей крупных городов практически приняло характер эпидемии.
Кофе, курение, алкоголь
Никотин сужает просвет сосудов и капилляров, пронизывающих костную и близлежащие ткани, что снижает обмен веществ в костно-хрящевой ткани и лишает ее полноценного питания. Никотин препятствует нормальному образованию половых гормонов, женский гормон эстроген у курящих женщин быстро превращается в неактивную форму. Происходит снижение концентрации половых гормонов в крови. Как следствие, у курящих женщин менопауза обычно наступает лет на пять раньше, чем у некурящих. Также доказано, что в организме курильщиков происходит накопление тяжелого металла кадмия, способствующего обширному разрежению костной ткани. Курение повышает риск возникновения переломов бедренной кости в три раза.
Алкоголь выводит из организма магний и калий, что в свою очередь, нарушает всасываемость минералов и водно-солевой баланс организма. Курение и чрезмерное употребление алкоголя приводит к снижению костной массы до 25%.
Ожирение
У больных ожирением встречаемость остеопороза может достигать 70%. Патологическое увеличение массы тела создает дополнительную нагрузку на опорно-двигательный аппарат, особенно на поясничный отдел позвоночника и бедренные кости. Это стимулирует усиление их минерализации. Этому же способствуют эстрогены, вырабатываемые в некотором количестве жировой тканью. Однако остальная костная масса подвергается значительной резорбции. Это происходит, прежде всего, вследствие резкого снижения двигательной активности, являющейся важнейшим фактором реминерализации костной ткани, и, как следствие, недостаточного пребывания на солнце, в результате чего у тучных людей часто развивается дефицит витамина D.
Чрезмерная нагрузка на опорно-двигательный аппарат при избыточном весе способствует развитию и других обменно-дистрофических заболеваний костно-суставной системы, таких как остеохондроз и полиартрит. Низкая физическая активность полных людей приводит к недостаточному питанию тканей позвоночника и суставов и нарушению в них обменных процессов, а в последствии и к развитию патологических изменений.
Чрезмерные физические нагрузки
Профессиональные спортсмены, подвергающиеся чрезмерным физическим нагрузкам, часто страдают различными заболеваниями костей и суставов. Умеренные физические нагрузки укрепляют кости и суставы, но слишком сильные быстро их изнашивают. При интенсивных физических занятиях человек с потом теряет много минеральных солей. Кроме того, интенсивные физические нагрузки ведут к сдвигу кислотно-щелочного баланса организма в кислую сторону. Если потеря минералов превышает их поступление в организм, возникает дефицит, снижение минеральной плотности костей и, как следствие, переломы.
Подростковый возраст
В подростковом периоде на фоне интенсивного роста часто возникает несоответствие между темпами роста костей и уровнем минералами. Это приводит к развитию так называемого ювенильного остеопороза, который рассматривают как временное физиологическое явление. Частота снижения минеральной плотности костной ткани у детей 11-16 лет колеблется от 5 до 44%. Максимум переломов в детском возрасте приходится на 13-14 лет.
В последние годы появились убедительные сведения о том, что истоки остеопороза взрослых нередко лежат в детском и подростковом возрасте. Недостаточная минерализация костной ткани в детстве приводит к высокой частоте переломов костей у взрослого человека в критические периоды жизни, как патологические, так и физиологические. Костное здоровье формируется в детстве, и если ребенка недокормили творогом, сыром, рыбой, шпинатом, сельдереем, морковкой, не развивали его физически, после 50-ти — жди проблем. Сколько в возрасте 8-20 лет нарастет костной массы, с такой человек и будет жить, нисколько больше не прибавляя. А укрепить кости наших детей помогут занятия спортом и витаминно-минеральные добавки.
Беременность и лактация
Во время беременности организм будущей матери испытывает повышенную потребность в витаминах и минеральных веществах, и, прежде всего, в кальции, железе и цинке. Кальций необходим для формирования костей и зубов ребенка. За время беременности и лактации женщина теряет около 50 г кальция. Во время беременности в организме женщины значительно увеличивается объем крови. А для синтеза гемоглобина требуется железо. Его недостаток может привести к развитию анемии беременных. Цинк участвует в формировании костей плода и при его недостатке ребенок может родиться слишком маленьким, недоношенным. Йод обеспечивает правильное развитие и функцию щитовидной железы у плода. Дефицит магния приводит к различным осложнениям у матери и плода, увеличивает вероятность преждевременных родов. При недостаточном поступлении этих минералов с пищей или плохой усвояемости организм матери вынужден восполнять их недостаток за счет деминерализации костной и зубной ткани. Длительный недостаток минералов во время беременности и в период лактации может привести к остеопении, выпадению волос, снижению эластичности кожи. В тяжелых случаях может даже произойти разрежение костей таза, поясничного, крестцового отдела, верхних отделов бедренных костей.
Заболевания костно-хрящевой системы
Постепенная деминерализация костной ткани приводит к развитию ряда заболеваний костей, суставов и зубов: остеопороз, остеохондроз, остеоартроз, пародонтоз и др.
Остеопороз
Остеопороз — системное заболевание скелета, для которого характерны снижение плотности кости и нарушение микроархитектоники костной ткани (в ней возникают пустоты-поры), что приводит к увеличению степени хрупкости костей и возрастанию риска переломов при минимальном воздействии. При остеопорозе исчезают целые участки костной ткани, кость теряет свою сложную архитектуру, становится рыхлой и ломается даже при небольшой нагрузке.
Снижение костной массы происходит безболезненно, иногда без всяких симптомов на протяжении десятков лет, в чем и состоит коварство болезни. Сначала развивается остеопения (пониженная костная масса), а когда потеря костной ткани достигает 20% и более, наступает клинический остеопороз.
Для болезни характерна нарастающая, ноющая боль в спине при движении, «боли усталости», возникающие после относительно длительного (больше 30 минут) пребывания в одной позе — стоя или сидя. Тогда обычно начинает болеть поясница или между лопатками. Как правило, боль исчезает, если немного полежать. Происходит деформация позвонков — они уменьшаются по высоте либо в передней части, принимая клиновидную форму (формируется «вдовий горб»), либо равномерно, вследствие чего рост человека может уменьшиться на 10-15 см. При этом за счет уменьшения высоты позвоночника могут формироваться кожные складки по бокам грудной клетки, и отвисает живот. Возрастная сутулость, уменьшение роста и любые, даже незначительные переломы, например, пальцев рук — стопроцентное свидетельство остеопороза. Существуют и другие, косвенные признаки заболевания. К ним относятся хрупкость ногтей и их расслоение, преждевременное поседение, пародонтоз, ночные судороги в икрах и стопах.
Заболевание страшно не само по себе, а своими последствиями — переломами. Потеря костной массы ухудшает структуру костной ткани и приводит к микропереломам (поначалу их можно увидеть лишь под микроскопом), которые, накапливаясь, приводят уже к более крупным переломам. Часто они происходят в лучевой кости, шейке бедра, позвоночнике даже при небольших воздействиях (падении, резком вставании с постели).
При этом возникают серьезные проблемы. Подсчитано, что у каждой третьей женщины после 65 лет обязательно происходит перелом тела позвонка. Возникающая при этом резкая боль может быть неверно истолкована как симптом сердечного приступа, инфаркта миокарда, воспаления легких или острое воспалительное заболевание брюшной полости.
Перелом лучевой кости (особенно справа) влечет за собой длительную потерю трудоспособности. Наиболее грозным является перелом шейки бедра. У каждого второго больного перелом бедра ведет к полной или частичной длительной инвалидизации. Каждый пятый умирает в течение шести месяцев после травмы из-за нарушений кровообращения, образования тромбов в сосудах, снижения защитных сил организма, присоединения инфекции. Из-за поражения костной ткани остеопорозом переломы срастаются медленно. Больные оказываются прикованными к постели, не могут обслуживать себя.
Остеопорозом страдают как женщины, так и мужчины. Некоторые виды остеопорозных травм угрожают каждой третьей женщине и каждому шестому мужчине, а в возрасте 70 лет — каждому второму жителю планеты независимо от пола. Традиционно остеопороз считался заболеванием пожилых людей. Но сейчас это заболевание стремительно молодеет. Изменения в образе жизни, характере питания, увлечение модными диетами привели к недоразвитию и дегенеративным изменениям в костной системе у молодых, и, казалось бы, здоровых людей. Страдают от остеопороза даже дети. У них заболевание вызвано недостатком не только кальция, но также цинка, фосфора, дисбактериозом кишечника, вследствие чего нарушен синтез витаминов и усвоение минералов в желудочно-кишечном тракте.
К остеопорозу ведет множество причин. Основной считается — возрастное снижение гормонального фона. Особенно это характерно для женщин. Безусловно, женщины среднего и старшего возраста — первая группа риска возникновения остеопороза. Но только ли эта категория подвержена заболеванию? В группу риска также входят:
хрупкие женщины с массой тела до 60 кг;
любители диет (особенно моно- и низкокалорийных);
лица с непереносимостью молочных продуктов;
злоупотребляющие кофе, газированными напитками, курением и алкоголем;
ведущие малоподвижный, сидячий образ жизни;
профессиональные спортсмены;
женщины с ранней менопаузой (до 40 лет) или удаленными яичниками;
лица с заболеваниями желудочно-кишечного тракта, крови, почек;
длительно (более 6 месяцев) принимающие глюкокортикоиды по поводу бронхиальной астмы, ревматоидного артрита;
подростки в период полового созревания.
Такое обилие факторов риска говорит о том, что в настоящее время угрозе развитию остеопороза подвергается практически каждая женщина! Это повод задуматься о собственном здоровье даже в том случае, если до клинических проявлений этого тяжелого недуга совсем далеко.
Остеохондроз
Остеохондроз — дегенеративно-дистрофическое заболевание позвоночника, затрагивающее все его ткани. Но наиболее уязвимым местом являются межпозвонковые диски, состоящие из жесткого хрящевого многослойного кольца и жидкого студенистого ядра в центре. Диски играют роль амортизатора и смазки при движении позвонков, поэтому в них происходит активный обмен веществ. В межпозвоночных дисках отсутствуют кровеносные сосуды. Их питание осуществляется путем диффузии питательных веществ из окружающих тканей, в основном мышечных.
Вследствие прямохождения наш позвоночник, и особенно межпозвонковые диски, испытывают значительные статические нагрузки. А любое движение создает дополнительные динамические нагрузки. Наиболее подвержена статическим нагрузкам поясница, поэтому там самые мощные позвонки, и опираются они на сросшееся в единое целое образование из 5 позвонков — крестец. Максимальная динамическая нагрузка падает на самые маленькие и подвижные шейные позвонки. Длительные нагрузки на определенный отдел позвоночника и соответствующие мышечные группы вызывают перенапряжение мышц, вследствие чего в них возникает спазм кровеносных сосудов, нарушается диффузное поступление необходимых тканям позвоночника питательных веществ. В межпозвонковых дисках и тканях позвонков возникает дефицит воды, аминокислот и микроэлементов. Ситуация ухудшается при хронической недостаточности в организме витаминов и минералов. Это сказывается на амортизирующей (пружинистой) функции диска. Под действием силы тяжести вышележащие позвонки сдавливают потерявший упругость диск, он уплощается и выпячивается, сдавливая межпозвонковые нервные корешки и вызывая их воспаление. Возникают хронические боли в спине, конечностях и других органах. В тяжелых случаях может даже возникнуть грыжа диска, сопровождающаяся сильнейшими болями — так называемый прострел.
Кроме межпозвонковых дисков при остеохондрозе страдают примыкающие к дискам хрящевые пластинки на поверхности тел позвонков, происходят нарушения в области мелких суставов позвоночника. Изменяются и сами позвонки. В них перестраивается костеобразующий процесс, формируются дополнительные разрастания костной ткани по краям тел позвонков. Это известное «отложение солей», которое со временем может ограничить подвижность данного отдела позвоночника.
Позвоночник — стержень всего организма. Через нервные окончания он связан со всеми органами нашего тела. Любые проблемы с позвоночником имеют прямое воздействие на наши внутренние органы и наоборот. Различают шейный, грудной и пояснично-крестцовый остеохондроз.
Поясничный остеохондроз является самым распространенным. При поясничном остеохондрозе наблюдаются боли и прострелы в спине, различные заболевания, связанные с сосудами ног, икрами, онемение конечностей. При тряске и резких нагрузках боли усиливаются. Радикулит нередко является следствием остеохондроза.
Шейный остеохондроз проявляется ноющими болями в затылке, боковом и заднем отделах шеи. Затрудняются движения головой. Такой вид остеохондроза может вызвать головные боли, головокружения, «мушки» и двоение в глазах, шум в ушах, ухудшения слуха, зрения, боли в руках, нарушения сердечной и дыхательной систем, заболевания гортани и некоторые другие. Это разнообразие симптомов обуславливается тем, что через шейную область проходят артерии, связанные с головным мозгом, спинной мозг, нервные стволы и корешки, с помощью которых осуществляется нервная связь с легкими, руками, сердцем.
Грудной остеохондроз является причиной проблем с сердцем, кишечником, также влияет на печень, почки, поджелудочную железу, возникают межреберные боли.
Остеохондроз стоит на втором месте по частоте распространения после сердечно-сосудистых заболеваний. Каждый человек подвержен остеохондрозу, с возрастом он проявляется практически у всех, но в разное время и развивается с разной скоростью. Наибольшая вероятность возникновения остеохондроза у людей, ведущих сидячий образ жизни, в том числе подолгу работающих за компьютером; у людей, часто поднимающих тяжести по роду своей деятельности; у беременных женщин, которые часто носят каблуки. В настоящее время нередки случаи заболевания остеохондрозом и у молодежи, вызванные современным образом жизни. Остеохондроз является следствием нарушения обмена веществ в позвоночнике, и особенно в межпозвонковых дисках. А причин такого нарушения множество: слабое физическое развитие, нахождение подолгу в неудобных позах, перенапряжение мышц, неправильная осанка, неправильное питание, стрессы, травмы позвоночника, плоскостопие, избыточный вес, инфекционные и эндокринные заболевания и т.д. Однако если принимать профилактические меры, то развитие заболевания можно значительно замедлить. Физические упражнения, спорт, правильное питание, обогащенное необходимыми для костно-хрящевой ткани веществами, в том числе витаминами и минералами, помогут Вам избежать остеохондроза.
Остеоартроз
Вам, наверное, знакома туговатость после периода покоя — например, сна, долгой сидячей работы. Тело как будто застаивается, и необходимо подвигаться, расходиться, чтобы вернуть легкость движений. А ведь подобный застой — первый признак старения суставов. Остеоартроз — собирательное понятие, включающее в себя несколько заболеваний, связанных с дегенеративными изменениями в тканях суставов. Признаки остеоартроза — нерезкие и непостоянные боли в суставах в состоянии покоя, проходящие при движении; болезненность при ощупывании, ограничения подвижности, «хруст» при движениях.
Остеоартроз сопровождается разрушением суставного хряща и прилегающей костной ткани. В развитии этого заболевания играют определенную роль повышенная функциональная нагрузка на суставы (в том числе вследствие избыточного веса), нарушение кровоснабжения суставов, но наибольшее значение имеют обменные нарушения. Все дело в том, что суставная жидкость вырабатывается в суставах только при движении. В норме она похожа по консистенции на жидкий киселек. При малой подвижности человека жидкость вырабатывается недостаточно интенсивно. Та, которая уже была выработана, застаивается, густеет, делаясь похожей на густой студень. Когда в организме не хватает кальция, кремния, неорганической серы (а такой дефицит практически у всех взрослых людей), зато имеется избыток мочевой кислоты (у любителей мяса), из суставной жидкости выпадают кристаллы солей, прикрепляясь на поверхности суставов. В результате суставной хрящ быстро обызвествляется (т.е. замещается минеральными солями) и теряет эластичность. Поверхность суставов теряет гладкость, движения затрудняются и вызывают боль. Происходит истирание суставных поверхностей и раннее старение суставов. В конечном итоге сустав полностью разрушается, теряет подвижность, человек становится инвалидом.
Зубы располагаются в костных лунках - отдельных ячейках альвеолярных отростков верхней и нижней челюстей. Костная ткань - разновидность соединительной ткани, развивающаяся из мезодермы и состоящая из клеток, межклеточного неминерализованного органического матрикса (остеоид) и основного минерализованного межклеточного вещества.
5.1. ОРГАНИЗАЦИЯ И СТРОЕНИЕ КОСТНОЙ ТКАНИ АЛЬВЕОЛЯРНЫХ ОТРОСТКОВ
Поверхность кости альвеолярного отростка покрыта надкостницей (периост ), образованной преимущественно плотной волокнистой соединительной тканью, в которой различают 2 слоя: наружный - волокнистый и внутренний - остеогенный, содержащий остеобласты. Из остеогенного слоя надкостницы в кость проходят сосуды и нервы. Толстые пучки прободающих коллагеновых волокон связывают кость с надкостницей. Надкостница осуществляет не только трофическую функцию, но и участвует в росте и регенерации кости. Вследствие этого костная ткань альвеолярных отростков обладает высокой регенеративной способностью не только в физиологических условиях, при ортодонтических воздействиях, но и после повреждения (переломы).
Минерализованный матрикс организован в трабекулы - структурно-функциональные единицы губчатой костной ткани. В лакунах минерализованного матрикса и по поверхности трабекул располагаются клетки костной ткани - остеоциты, остеобласты, остеокласты.
В организме постоянно происходят процессы обновления костной ткани путём сопряженного по времени костеобразования и рассасы- вания (резорбция) кости. В этих процессах активно участвуют различные клетки костной ткани.
Клеточный состав костной ткани
Клетки занимают всего лишь 1-5% общего объёма костной ткани скелета взрослого человека. Различают 4 типа клеток костной ткани.
Мезенхимальные недифференцированные клетки кости находятся главным образом в составе внутреннего слоя надкостницы, покрывающей поверхность кости снаружи - периоста, а также в составе эндоста, выстилающего контуры всех внутренних полостей кости, внутренние поверхности кости. Их называют выстилающими , или контурными , клетками. Из этих клеток могут образовываться новые клетки кости - остеобласты и остеокласты. В соответствии с этой их функцией их также называют остеогенными клетками.
Остеобласты - клетки, находящиеся в зонах костеобразования на внешних и внутренних поверхностях кости. Остеобласты содержат достаточно большое количество гликогена и глюкозы. С возрастом это количество уменьшается в 2-3 раза. Синтез АТФ на 60% связан с реакциями гликолиза. По мере старения остеобластов реакции гликолиза активируются. В клетках протекают реакции цитратного цикла, и наибольшей активностью обладает цитратсинтаза. Синтезируемый цитрат используется в дальнейшем на связывание Ca 2+ , необходимого для процессов минерализации. Поскольку функцией остеобластов является создание органического межклеточного матрикса кости, эти клетки содержат большое количество РНК, необходимых для синтеза белков. Остеобласты активно синтезируют и выделяют во внеклеточное пространство значительное количество глицерофосфолипидов, которые способны связывать Ca 2+ и участвовать в процессах минерализации. Клетки сообщаются между собой через десмосомы, которые позволяют проходить Ca 2+ и цАМФ. Остеобласты синтезируют и выделяют в окружающую среду фибриллы коллагена, протеогликаны и гликозаминогликаны. Они также обеспечивают непрерывный рост кристаллов гидроксиапатитов и выступают в качестве посредников при связывании минеральных кристаллов с белковой матрицей. По мере старения остеобласты превращаются в остеоциты.
Остеоциты - древовидные клетки костной ткани, включенные в органический межклеточный матрикс, которые контактируют друг с другом через отростки. Остеоциты взаимодействуют и с другими клетками костной ткани: остеокластами и остеобластами, а также с мезенхимальными клетками кости.
Остеокласты - клетки, выполняющие функцию разрушения кости; образуются из макрофагов. Они осуществляют непрерывный управляемый процесс реконструкции и обновления костной ткани, обеспечивая необходимый рост и развитие скелета, структуру, прочность и упругость костей.
Межклеточное и основное вещество костной ткани
Межклеточное вещество представлено органическим межклеточным матриксом, построенным из коллагеновых волокон (90-95%) и основным минерализованным веществом (5-10%). Коллагеновые волокна в основном расположены параллельно направлению уровня наиболее вероятных механических нагрузок на кость и обеспечивают упругость и эластичность кости.
Основное вещество межклеточного матрикса состоит главным образом из внеклеточной жидкости, гликопротеинов и протеогликанов, участвующих в перемещении и распределении неорганических ионов. Минеральные вещества, размещённые в составе основного вещества в органическом матриксе кости представлены кристаллами, главным образом гидроксиапатитом Ca 10 (PO 4) 6 (OH) 2 . Соотношение кальций/фосфор в норме составляет 1,3-2,0. Кроме того, в кости обнаружены ионы Mg 2+ , Na + , K + , SO 4 2- , HCO 3- , гидроксильные и другие ионы, которые могут принимать участие в образовании кристаллов. Минерализация кости связана с особенностями гликопротеинов костной ткани и активностью остеобластов.
Основными белками внеклеточного матрикса костной ткани являются коллагеновые белки I типа, которые составляют около 90% органического матрикса кости. Наряду с коллагеном I типа присутствуют следы других типов коллагена, таких как V, XI, XII. Не исключено, что эти типы коллагена принадлежат другим тканям, которые и находятся в костной ткани, но не входят в состав костного матрикса. Например, коллаген V типа обычно обнаруживается в сосудах, которые пронизывают кость. Коллаген XI типа находится в хрящевой ткани и может соответствовать остаткам кальцифицированного хряща. Источником коллагена XII типа могут быть «заготовки» коллагеновых фибрилл. В костной ткани коллаген I типа содержит производные моносахаридов, имеет меньшее количество поперечных связей, чем в других видах соединительной ткани, и эти связи формируются посредством аллизина. Ещё одним возможным отличием является то, что N-концевой пропептид коллагена I типа фосфорилирован и этот пептид частично сохраняется в минерализованном матриксе.
В костной ткани содержится около 10% неколлагеновых белков. Они представлены гликопротеинами и протеогликанами (рис. 5.1).
Из общего количества неколлагеновых белков 10% приходится на долю протеогликанов. Вначале синтезируется большой хондроитин-
Рис. 5.1. Содержание неколлагеновых белков в межклеточном матриксе костной ткани [по Gehron R. P., 1992].
содержащий протеогликан, который по мере формирования костной ткани разрушается и замещается двумя малыми протеогликанами: декорином и бигликаном. Малые протеогликаны внедряются в мине- рализованный матрикс. Декорин и бигликан активируют процессы дифференцировки и пролиферации клеток, а также вовлечены в регуляцию отложения минералов, морфологию кристалла и объединение элементов органического матрикса. Первым синтезируется бигликан, содержащий дерматансульфат; он влияет на процессы клеточной пролиферации. В фазу минерализации появляется бигликан, связаный с хондроитинсульфатом. Декорин синтезируется позднее, чем бигликан, в стадию отложения белков для формирования межклеточного матрикса; он остаётся и в фазе минерализации. Предполагают, что декорин «отшлифовывает» молекулы коллагена и регулирует диаметр фибрилл. В ходе формирования кости оба белка продуцируются остеобластами, но когда эти клетки становятся остеоцитами, они синтезируют только бигликан.
Из костного матрикса в небольших количествах были выделены и другие типы малых протеогликанов, которые выступают в качестве
рецепторов и облегчают связывание факторов роста с клеткой. Эти типы молекул находятся в мембране или прикрепляются к клеточной мембране посредством фосфоинозитоловых связей.
В костной ткани также присутствует гиалуроновая кислота. Вероятно, она играет важную роль в морфогенезе этой ткани.
Помимо протеогликанов в кости определяется большое количество разнообразных белков, относящихся к гликопротеинам (табл. 5.1).
Как правило, эти белки синтезируются остеобластами и способны связывать фосфаты или кальций; таким образом они принимают участие в формировании минерализованного матрикса. Связываясь с клет- ками, коллагенами и протеогликанами, они обеспечивают образование надмолекулярных комплексов матрикса костной ткани (рис. 5.2).
В остеоиде присутствуют протеогликаны: фибромодулин, бигликан, декорин, коллагеновые белки и морфогенетический белок кости. В минерализованном матриксе замурованы остеоциты, которые связаны с коллагенами. На коллагенах фиксированы гидроксиапатиты, остеокальцин, остеоадерин. В минерализованном межклеточном

Рис. 5.2. Участие различных белков в образовании матрикса костной ткани.
Таблица 5.1
Неколлагеновые белки костной ткани
Белок | Свойства и функции |
Остеонектин | Гликофосфопротеин, способный связывать Са 2+ |
Щелочная фосфатаза | Отщепляет фосфат от органических соединений при щелочных значениях pH среды |
Тромбоспондин | Белок с мол. массой 145 кДа, состоящий из трех идентичных субъединиц, связанных друг с другом дисульфидными связями. Каждая субъединица имеет несколько различных доменов, которые придают белку способность связываться с другими белками костного матрикса - гепарансодержащими протеогликанами, фибронектином, ламинином, коллагеном I и V типов и остеонектином. В N-кон- цевой области тромбоспондина содержится последовательность аминокислот, обеспечивающая прикрепление клеток. На связывание тромбоспондина с рецепторами на поверхности клетки влияет кон- центрация Ca 2+ . В костной ткани тромбоспондин синтезируется остеобластами |
Фибронектин | Связывается с поверхностью клеток, фибрином, гепарином, бактериями, коллагеном. В костной ткани фибронектин синтезируется на ранних стадиях остеогенеза и сохраняется в минерализован- ном матриксе |
Остеопонтин | Гликофосфопротеин, содержащий N- и О-связанные олигосахариды; участвует в адгезии клеток |
Костный кислый гликопротеин-75 | Белок с мол. массой 75 кДа, содержит сиаловые кислоты и остатки фосфата. Способен связывать ионы Са 2+ , присущ кости, дентину и хрящевой ростковой пластинке. Ингибирует процессы резорбции костной ткани |
Костный сиалопротеин | Адгезивный гликопротеин, содержащий до 50% углеводов |
Матриксный Gla-белок | Белок, содержащий 5 остатков 7-карбоксиглутами- новой кислоты; способен связываться с гидроксиапатитом. Появляется на ранних стадиях развития костной ткани; белок обнаружен также в лёгких, сердце, почках, хряще |
матриксе остеоадерин связывается с остеонектином, а остеокальцин с коллагеном. Морфогенетический белок кости располагается в приграничной зоне между минерализованным и неминерализованным матриксом. Остеопонтин регулирует активность остеокластов.
Свойства и функции белков костной ткани представлены в табл. 5.1.
5.2. ФИЗИОЛОГИЧЕСКАЯ РЕГЕНЕРАЦИЯ КОСТНОЙ ТКАНИ
В процессе жизнедеятельности кость постоянно обновляется, то есть разрушается и восстанавливается. При этом в ней происходят два противоположно направленных процесса - резорбция и восстановление. Соотношение этих процессов называется ремоделированием костной ткани.
Известно, что каждые 30 лет костная ткань изменяется почти полностью. В норме кость «растет» до 20-летнего возраста, достигая пика костной массы. В этот период прирост костной массы составляет до 8% в год. Далее до 30-35-летнего возраста идет период более или менее устойчивого состояния. Затем начинается естественное постепенное снижение костной массы, составляющее обычно не более 0,3-0,5% в год. После наступления менопаузы у женщин отмечается максимальная скорость потери костной ткани, которая достигает 2-5% в год и продолжается в таком темпе до 60-70 лет. В итоге женщины теряют от 30 до 50% костной ткани. У мужчин эти потери обычно составляют 15-30%.
Процесс ремоделирования костной ткани происходит в несколько этапов (рис. 5.3). На первом этапе участок костной ткани, подле-

Рис. 5.3. Стадии ремоделирования костной ткани [по Martin R.B., 2000, с изменениями].
жащий резорбции запускают остеоциты. Для активации процесса необходимо участие паратиреоидного гормона, инсулиноподобного фактора роста, интерлейкинов-1 и -6, простагландинов, кальцитриола, фактора некроза опухоли. Тормозится этот этап ремоделирования эстрогенами. На данном этапе поверхностные контурные клетки изменяют свою форму, превращаясь при этом из плоских округлых клеток в кубические.
Остеобласты и Т-лимфоциты секретируют лиганды рецепторов активатора фактора нуклеации каппа В (RANKL) и до определённого момента молекулы RANKL могут оставаться связанными с поверхностью остеобластов или стромальных клеток.
Из стволовой клетки костного мозга образуются предшественники остеокластов. Они имеют мембранные рецепторы, называемые рецепторами активатора фактора нуклеации каппа В (RANK). На следующем этапе RANK-лиганды (RANKL) связываются с RANK- рецепторами, что сопровождается слиянием нескольких предшественников остеокластов в одну крупную структуру и формируются зрелые многоядерные остеокласты.
Образующийся активный остеокласт создаёт на своей поверхности гофрированный край и зрелые остеокласты начинают резорбировать
костную ткань (рис. 5.4). На стороне прилегания остеокласта к разрушаемой поверхности различают две зоны. Первая зона - наиболее обширная, называемая щеточной каемкой, или гофрированным краем. Гофрированный край - это скрученная спиралью мембрана с множественными цитоплазматическими складками, которые обращены в сторону резорбции на костной поверхности. Через мембрану остеокласта освобождаются лизосомы, содержащие большое количество гидролитических ферментов (катепсины К, D, B, кислая фосфатаза, эстераза, гликозидазы и др). В свою очередь, катепсин К активирует матриксную металлопротеиназу-9, которая участвует в деградации коллагена и протеогликанов межклеточного матрикса. В этот период в остеокластах растёт активность карбоангидразы. Ионы НСО 3 - обме- ниваются на Cl - , которые накапливаются в гофрированном крае; туда же переносятся ионы H + . Секреция H + осуществляется за счёт очень активной в остеокластах Н + /К + -АТФазы. Развивающийся ацидоз способствует активации лизосомных ферментов и способствует разруше- нию минерального компонента.
Вторая зона окружает первую и как бы герметизирует область действия гидролитических ферментов. Она свободна от органелл и назы-

Рис. 5.4. Активация преостеокласта RANKL и формирование активным остеобластом гофрированной каймы, приводящей к резорбции костной ткани [по Edwards P. A., 2005, с изменениями].
вается чистой зоной, поэтому костная резорбция происходит только под гофрированным краем в замкнутом пространстве.
На стадии образования остеокластов из предшественников процесс может блокироваться белком остеопротегерином, который, свободно перемещаясь, способен связывать RANKL и таким образом предотвращать взаимодействие RANKL с RANK-рецепторами (см. рис. 5.4). Остеопротегерин - гликопротеин с мол. массой 60-120 кДа, относящийся к семейству рецепторов ФНО. Ингибируя связывание RANK с RANK-лигандом, остеопротегерин тем самым подавляет мобилизацию, пролиферацию и активацию остеокластов, поэтому увеличение синтеза RANKL приводит к резорбции костной ткани и, следовательно, к потере костной массы.
Характер ремоделирования костной ткани во многом определяется балансом между продукцией RANKL и остеопротегерина. Недифференцированные стромальные клетки костного мозга в большей степени синтезируют RANKL и в меньшей степени остеопротегерин. Возникающий дисбаланс системы RANKL/остеопротегерин при увеличении RANKL приводит к резорбции кости. Данное явление наблюдается при постменопаузальном остеопорозе, болезни Педжета, костных потерях при метастазах рака и ревматоидном артрите.
Зрелые остеокласты начинают активно поглощать кость, а завершают разрушение органической матрицы межклеточного вещества кости макрофаги. Резорбция длится около двух недель. Затем остеокласты в соответствии с генетической программой умирают. Апоптоз остеокластов может задерживаться при недостатке эстрогенов. На последнем этапе в зону разрушения прибывают плюрипотентные стволовые клетки, которые дифференцируются в остеобласты. В дальнейшем остеобласты синтезируют и минерализуют матрикс в соответствии с новыми условиями статической и динамической нагрузки на кость.
Существует большое число факторов, стимулирующих развитие и функции остеобластов (рис. 5.5). Вовлечение в процесс перестройки кости остеобластов стимулируется различными факторами роста - ТФР-(3, морфогенетическим белком кости, инсулиноподобным фактором роста, фактором роста фибробластов, тромбоцитов, колониестимулирующим и гормонами - паратирином, кальцитриолом, а также связывающим фактором ядра α-1 и тормозится белком лептином. Лептин - белок с мол. массой 16 кДа образуется преимущественно в адипоцитах; своё действие реализует через повышение синтеза цитокинов, факторов роста эпителия и кератиноцитов.

Рис. 5.5. Ремоделирование костной ткани.
Активные секретирующие остеобласты создают слои остеоида - неминерализованного матрикса кости и медленно восполняют полость резорбции. При этом они секретируют не только различные факторы роста, а также белки межклеточного матрикса - остеопонтин, остеокальцин и другие. Когда образующийся остеоид достигает диаметра 6?10 -6 м, он начинает минерализоваться. Скорость процесса минерализации зависит от содержания кальция, фосфора и ряда микроэлементов. Процесс минерализации управляется остеобластами и тормозится пирофосфатом.
Образование кристаллов минерального остова кости индуцирует коллаген. Формирование минеральной кристаллической решётки начинается в зоне, находящейся между коллагеновыми фибриллами. Затем они, в свою очередь, становятся центрами для отложения в пространстве между коллагеновыми волокнами (рис. 5.6).
Формирование кости происходит только в непосредственной близости от остеобластов, причём минерализация начинается в хряще,

Рис. 5.6. Отложение кристаллов гидроксиапатита на коллагеновых волокнах.
который состоит из коллагена, находящегося в протеогликановом матриксе. Протеогликаны повышают растяжимость коллагеновой сети. В зоне кальцификации происходит разрушение комплексов белок-полисахарид в результате гидролиза белкового матрикса лизосомальными ферментами клеток кости. По мере роста кристаллы вытесняют не только протеогликаны, но и воду. Плотная, полностью минерализованная кость, практически обезвожена; коллаген составляет 20% массы и 40% объема такой ткани; остальное приходится на долю минеральной части.
Начало минерализации характеризуется усиленным поглощением остеобластами молекул O 2 , активацией окислительно-восстановительных процессов и окислительного фосфорилирования. В митохондриях накапливаются ионы Ca 2+ и PO 4 3- . Начинается синтез коллагеновых и неколлагеновых белков, которые затем после посттрансляционной модификации секретируются из клетки. Формируются различные везикулы, в составе которых переносится коллаген, протеогликаны и гликопротеины. От остеобластов отпочковываются особые образования, называемые матриксными пузырьками, или мембранными везикулами. Они содержат в большой концентрации ионы Ca 2+ , которая превышает в 25-50 раз содержание их в остеобластах, а также глицерофосфолипиды и ферменты - щелочную фосфатазу, пирофосфатазу,
аденозинтрифосфатазу и аденозинмонофосфатазу. Ионы Ca 2+ в мембранных везикулах связаны преимущественно с отрицательно заряженым фосфатидилсерином. В межклеточном матриксе мембранные везикулы разрушаются с освобождением ионов Ca 2+ , пирофосфатов, органических соединений, связанных с остатками фосфорной кислоты. Присутствующие в мембранных везикулах фосфогидролазы, и в первую очередь щелочная фосфатаза, отщепляют фосфат от органических соединений, а пирофосфат гидролизуется пирофосфатазой; ионы Ca 2+ соединяются с PO 4 3- , что приводит к появлению аморфного фосфата кальция.
Одновременно происходит частичное разрушение протеогликанов, связанных с коллагеном I типа. Освобождающиеся фрагменты протеогликанов, заряженные отрицательно, начинают связывать ионы Ca 2+ . Некоторое число ионов Ca 2+ и PO 4 3 образуют пары и триплеты, которые связываются с коллагеновыми и неколлагеновыми белками, формирующими матрицу, что сопровождается образованием кластеров, или ядер. Из белков костной ткани наиболее активно связывают ионы Ca 2+ и PO 4 3 остеонектин и матриксные Gla-белки. Коллаген костной ткани связывает ионы РО 4 3 через ε-аминогруппу лизина с образованием фосфоамидной связи.
На образовавшемся ядре возникают спиралевидые структуры, рост которых идет по обычному принципу добавления новых ионов. Шаг такой спирали равен высоте одной структурной единицы кристалла. Формирование одного кристалла приводит к появлению других кристаллов; этот процесс называется эпитаксисом, или эпитаксической нуклеацией.
Рост кристалла высоко чувствителен к присутствию других ионов и молекул, которые ингибируют кристаллизацию. Концентрация этих молекул может быть небольшой, и они оказывают влияние не только на скорость, но на форму и направление роста кристаллов. Предполагают, что такие соединения адсорбируются на поверхности кристалла и тормозят адсорбцию других ионов. Такими веществами являются, например, гексаметафосфат натрия, который тормозит преципитацию карбоната кальция. Пирофосфаты, полифосфаты и полифосфонаты также тормозят рост кристаллов гидроксиапатита.
Через несколько месяцев, после того как полость резорбции восполнится костной тканью, плотность новой кости увеличивается. Остеобласты начинают превращаться в контурные клетки, которые участвуют в непрерывном выведении кальция из кости. Некоторые
из остеобластов превращаются в остеоциты. Остеоциты остаются в кости; они связаны друг с другом длинными клеточными отростками и способны воспринимать механические воздействия на кость.
По мере дифференцировки и старения клеток меняется характер и интенсивность обменных процессов. С возрастом в 2-3 раза уменьшается количество гликогена; освобождающаяся глюкоза в молодых клетках на 60% используется в реакциях анаэробного гликолиза, а в старых на 85%. Синтезированные молекулы АТФ необходимы для жизнеобеспечения и минерализации костных клеток. В остеоцитах остаются лишь следы гликогена, и основным поставщиком молекул АТФ является только гликолиз, за счёт которого поддерживается постоянство органического и минерального состава в уже минерализованных отделах костной ткани.
5.3. РЕГУЛЯЦИЯ МЕТАБОЛИЗМА В КОСТНОЙ ТКАНИ
Ремоделирование костной ткани регулируется системными (гормоны) и местными факторами, которые обеспечивают взаимодейс- твие между остеобластами и остеокластами (табл. 5.2).
Системные факторы
Образование кости в известной степени зависит от числа и активности остеобластов. На процесс образования остеобластов влияют
Таблица 5.2
Факторы, регулирующие процессы ремоделирования кости

соматотропин (гормон роста), эстрогены, 24,25(ОН) 2 D 3 , которые стимулируют деление остеобластов и превращение преостеобластов в остеобласты. Глюкокортикоиды, напротив, подавляют деление остеобластов.
Паратирин (паратгормон) синтезируется в паращитовидных железах. Молекула паратирина состоит из одной полипептидной цепи, содержащей 84 аминокислотных остатков. Синтез паратирина стимулирует адреналин, поэтому в условиях острого и хронического стресса количество этого гормона увеличивается. Паратирины активирует пролиферацию клеток-предшественников остеобластов, продлевает время их полужизни и ингибирует апоптоз остеобластов. В костной ткани рецепторы для паратирина присутствуют в мембранах остеобластов и остеоцитов. Остеокласты лишены рецепторов для данного гормона. Гормон связывается с рецепторами остеобластов и активирует аденилатциклазу, что сопровождается увеличением количества 3" 5" цАМФ. Такое повышение содержания цАМФ способствует интенсивному поступлению ионов Ca 2+ из внеклеточной жидкости. Поступивший кальций образует комплекс с кальмодулином и далее происходит активация кальцийзависимой протеинкиназы с последующим фос- форилированием белков. Связываясь с остеобластами, паратирин вызывает синтез остеокласт-активирующего фактора - RANKL, способного связываться с преостеокластами.
Введение больших доз паратирина приводит к гибели остеобластов и остеоцитов, что сопровождается увеличением зоны резорбции, повышением уровня кальция и фосфатов в крови и моче с одновре- менным повышением экскреции гидроксипролина вследствие разрушения коллагеновых белков.
Рецепторы к паратирину располагаются и в почечных канальцах. В проксимальных отделах почечных канальцев гормон ингибирует реабсорбцию фосфата и стимулирует образование 1,25(ОН) 2 D 3 . В дистальных отделах почечных канальцев паратирин усиливает реабсорбцию Ca 2+ . Таким образом, паратирин обеспечивает повышение уровня кальция и снижение фосфатов в плазме крови.
Паротин - гликопротеин, выделяемый околоушными и поднижне- челюстными слюнными железами. Белок состоит из α-, β -, и γ-субъединиц. Активным началом паротина является γ-субъединица, которая оказывает влияние на мезенхимные ткани - хрящ, трубчатые кости, дентин зуба. Паротин усиливает пролиферацию хондрогенных клеток, стимулирует синтез нуклеиновых кислот и ДНК в одонтобластах, про-
цессы минерализации дентина и костей. Эти процессы сопровождаются понижением содержания кальция и глюкозы в плазме крови.
Кальцитонин - полипептид, состоящий из 32 аминокислотных остат- ков. Секретируется парафолликулярными К-клетками щитовидной железы или С-клетками паращитовидных желёз в виде высокомолекулярного белка-предшественника. Секреция кальцитонина возрастает при увеличении концентрации ионов Са 2+ и уменьшается при понижении концентрации ионов Са 2+ в крови. Она также зависит от уровня эстрогенов. При недостатке эстрогенов секреция кальцитонина снижается. Это вызывает усиление мобилизации кальция в костной ткани и способствует развитию остеопороза. Кальцитонин связывается с специфическими рецепторами остеокластов и клеток почечных канальцев, что сопровождается активацией аденилатциклазы и повышением образования цАМФ. Кальцитонин влияет на транспорт ионов Ca 2+ через клеточные мембраны. Он стимулирует поглощение ионов Ca 2+ митохондриями и тем самым задерживает отток ионов Ca 2+ из клетки. Этот зависит от количества АТФ и соотношения ионов Na + и K + в клетке. Кальцитонин угнетает распад коллагена, что проявляется уменьшением экскреции с мочой гидроксипролина. В клетках почечных канальцев кальцитонин ингибирует гидроксилирование 25(ОН)D 3 .
Таким образом, кальцитонин подавляет активность остеокластов и ингибирует освобождение ионов Ca 2+ из костной ткани, а также уменьшает реабсорбцию ионов Ca 2+ в почках. В результате тормозится резорбция костной ткани, стимулируются процессы минерализации, что проявляется понижением уровня кальция и фосфора в плазме крови.
Йодсодержащие гормоны щитовидной железы - тироксин (Т4) и трийодтиронин (Т3) обеспечивают оптимальный рост костной ткани. Тиреоидные гормоны способны стимулировать секрецию гормонов роста. Они повышают как синтез мРНК инсулиноподобного фактора роста 1 (ИФР-1), так и продукцию самого ИФР-1 в печени. При гипертиреозе подавляется дифференцировка остеогенных клеток и синтез белка в этих клетках, снижается активность щелочной фосфатазы. За счёт усиленной секреции остеокальцина активируется хемотаксис остеокластов, что ведёт к резорбции костной ткани.
Половые стероидные гормоны участвуют в процессах ремоделирования костной ткани. Воздействие эстрогенов на костную ткань проявляется в активации остеобластов (прямое и опосредованное действие), угнетении остеокластов. Они также способствуют всасыванию ионов Ca 2+ в желудочно-кишечном тракте и его отложению в костной ткани.
Женские половые гормоны стимулируют продукцию кальцитонина щитовидной железой и снижают чувствительность костной ткани к паратирину. Они также вытесняют на конкурентной основе кортикостероиды из их рецепторов в костной ткани. Андрогены, оказывая анаболическое действие на костную ткань, стимулируют биосинтез белка в остеобластах, а также ароматизируются в жировой ткани в эстрогены.
В условиях дефицита половых стероидов, который имеет место в менопаузе, процессы костной резорбции начинают преобладать над процессами ремоделирования костной ткани, что и приводит к раз- витию остеопении и остеопороза.
Глюкокортикоиды синтезируются в коре надпочечников. Основной глюкокортикоид человека - кортизол. Глюкокортикоиды скоординировано действуют на разные ткани и разные процессы - как анаболические, так и катаболические. В костной ткани кортизол тормозит синтез коллагена I типа, некоторых неколлагеновых белков, протеогликанов и остеопонтина. Глюкокортикоиды также уменьшают количество тучных клеток, являющихся местом образования гиа- луроновой кислоты. Под влиянием глюкокортикоидов ускоряется распад белков. Глюкокортикоиды подавляют всасывание ионов Ca 2+ в кишечнике, что сопровождается снижением его в сыворотке крови. Это понижение приводит к выбросу паратирина, который стимулирует образование остеокластов и резорбцию кости (рис. 5.7). Кроме того, кортизол в мышцах и костях стимулирует распад белков, что также нарушает формирование костной ткани. В конечном итоге действия глюкокортикоидов приводят к убыли костной ткани.
Витамин D 3 (холекальциферол) поступает с пищей, а также образуется из предшественника 7-дегидрохолестерола под влиянием ультрафиолетовых лучей. В печени холекальциферол превращается в 25(ОН)D 3 , а в почках происходит дальнейшее гидроксилирование 25(ОН)D 3 и образуются 2 гидроксилированных метаболита - 1,25(ОН) 2 D 3 и 24,25(ОН) 2 D 3 . Метаболиты витамина D 3 регулируют хондрогенез и остеогенез уже в процессе эмбрионального развития. В отсутствии витамина D 3 невозможна минерализация органического матрикса, при этом не образуется сосудистая сеть, а метафизарная кость не способна сформироваться должным образом. 1,25(ОН) 2 D 3 связывается с хондробластами, находящимся в активном состоянии, а 24,25(ОН) 2 D 3 - с клетками в состоянии покоя. 1,25(ОН) 2 D 3 регулирует зоны роста через образование комплекса с ядерным рецептором для этого витамина. Также показано, что 1,25(ОН) 2 D 3 способен связы-
Рис. 5.7. Схема влияния глюкокортикоидов на обменные процессы, приводящие к убыли костной ткани
ваться с мембранно-ядерным рецептором, что приводит к активации фосфолипазы С и образованию инозитол-3-фосфата. Кроме того, образующийся комплекс активируется фосфолипазой А 2 . Из осво- бождающейся арахидоновой кислоты синтезируется простагландин Е 2 , который также влияет на ответ хондробластов при их связывании с 1,25(ОН) 2 D 3 . Напротив, после связывания 24,25(ОН) 2 D 3 со своим мембранно-связывающимся рецептором, активируется фосфолипаза С, а затем протеинкиназа С.
В хрящевой зоне роста эпифизов костной ткани 24,25(ОН) 2 D 3 стимулирует дифференцировку и пролиферацию прехондробластов, которые содержат специфические рецепторы к данному метаболиту. Метаболиты витамина D 3 оказывают влияние на формирование и функциональное состояние височно-нижнечелюстного сустава.
Витамин А . При недостатке и избыточном поступлении витамина А в организм детей нарушается рост костей и происходит их деформация. Вероятно, эти явления обусловлены деполимеризацией и гидролизом хондроитинсульфата, входящего в состав хряща.

Витамин С . При недостатке аскорбиновой кислоты в мезенхемаль- ных клетках не происходит гидроксилирование остатков лизина и пролина, что приводит к нарушению образования зрелого коллагена. Образующийся незрелый коллаген не способен связывать ионы Ca 2+ и таким образом нарушаются процессы минерализации.
Витамин Е . При дефиците витамина Е в печени не образуется 25(ОН)D 3 - предшественник активных форм витамина D 3 . Дефицит витамина Е также может привести к снижению уровня магния в костной ткани.
Локальные факторы
Простагландины ускоряют выход ионов Ca 2+ из кости. Экзогенные простагландины увеличивают генерацию остеокластов, которые раз- рушают кость. Оказывают катаболическое воздействие на обмен белков в костной ткани и ингибирует их синтез.
Лактоферрин - железосодержащий гликопротеин, в физиологической концентрации стимулирует пролиферацию и дифференцировку остеобластов, а также ингибирует остеокластогенез. Митогенный эффект лактоферрина на остеобластоподобные клетки осуществляется через специфические рецепторы. Образовавшийся комплекс путём эндоцитоза поступает в клетку, и лактоферрин фосфорилирует митоген - активирующие протеинкиназы. Таким образом, лактоферрин выполняет роль фактора роста кости и её здоровья. Может применяться в качестве анаболического фактора при остеопорозе.
Цитокины - низкомолекулярные полипептиды, обусловливающие взаимодействие клеток иммунной системы. Они обеспечивают ответную реакцию на внедрение чужеродных тел, иммунное повреждение, а также воспаления, репарации и регенерации. Они представлены пятью большими группами белков, одной из которых являются интерлейкины.
Интерлейкины (ИЛ ) - белки (от ИЛ-1 до ИЛ-18), синтезируемые в основном Т-клетками лимфоцитов, а также мононуклеарными фагоцитами. Функции ИЛ связаны с активностью других физиологически активных пептидов и гормонов. В физиологической концентрации подавляют рост, дифференцировку и продолжительность жизни клеток. Cнижают продукцию коллагеназы, адгезию эндотелиальных клеток к нейтрофилам и эозинофилам, продукцию NO и, как следс- твие, наблюдается уменьшение деградации хрящевой ткани и резорбция кости.
Процесс резорбции костной ткани может активироваться при ацидозе и большими количествами интегринов, ИЛ и витамина A, но тормозится эстрогенами, кальцитонином, интерфероном и морфогенетическим белком кости.
Маркёры метаболизма костной ткани
Биохимические маркёры дают информацию о патогенезе заболеваний скелета и о фазах ремоделирования костной ткани. Различают биохимические маркёры формирования и резорбции кости, характе- ризующие функции остеобластов и остеокластов.
Прогностическая значимость определения маркёров метаболизма костной ткани:
Проведённый скрининг с использованием данных маркёров позволяет определить пациентов с высоким риском развития остеопороза; высокие уровни маркёров резорбции костей могут быть связаны с
увеличением риска переломов; повышение уровня маркёров метаболизма костной ткани у пациентов с остеопорозом более чем в 3 раза по сравнению с показателями нормы предполагает иную костную патологию, включая злокачественную; маркёры резорбции могут быть использованы в качестве дополнительных критериев при решении вопроса о назначении специальной терапии при лечении костной патологии. Маркёры резорбции кости . Во время обновления костной ткани коллаген I типа, который составляет более 90% органического матрикса кости и синтезируется непосредственно в костях, деградирует, а небольшие пептидные фрагменты попадают в кровь или выделяются почками. Продукции деградации коллагена можно определять как в моче, так и в сыворотке крови. Эти маркёры можно использовать при терапии препаратами, снижающими резорбцию костей, у пациентов с болезнями, связанными с нарушениями метаболизма костной ткани. В качестве критериев резорбции костной ткани выступают продукты деградации коллагена I типа: N- и С-телопептиды и тартрат-резистентная кислая фосфатаза. При первичном остеопорозе и болезни Педжета происходит отчетливое повышение С-концевого телопептида коллагена I типа и количество этого маркёра увеличивается в сыворотке крови в 2 раза.
Распад коллагена - единственный источник свободного гидроксипролина в организме. Преобладающая часть гидроксипролина
катаболизируется, а часть выделяется с мочой, главным образом, в составе небольших пептидов (ди- и трипептидов). Поэтому содержание гидроксипролина в крови и моче отражает баланс скорости катаболизма коллагена. У взрослого человека в сутки экскретируется 15-50 мг гидроксипролина, в молодом возрасте до 200 мг, а при некоторых болезнях, связанных с поражением коллагена, например: гиперпаратироидизме, болезни Педжета и наследственной гипергидроксипролинемии, причиной которой является дефект фермента гидроксипролиноксидазы, количество в крови и выделяемого с мочой гидроксипролина увеличивается.
Остекласты секретируют тартрат-резистентную кислую фосфатазу. При возрастании активности остеокластов происходит увеличение содержания тартрат-резистентной кислой фосфатазы и она попадает в повышенном количестве в кровоток. В плазме крови активность этого фермента возрастает при болезни Педжета, онкологических заболеваниях с метастазами в кость. Определение активности этого фермента особенно полезно при мониторинге лечения остеопороза и онкологических заболеваний, сопровождающихся поражением костной ткани.
Маркёры формирования кости . Формирование костной ткани оценивают по количеству остеокальцина, костного изофермента щелочной фосфатазы и остеопротегерина. Измерение количества сывороточного остеокальцина позволяет определять риск развития остеопороза у женщин, проводить мониторинг костного метаболизма во время менопаузы и гормональной заместительной терапии. Рахит у детей раннего возраста сопровождается снижением в крови содержания остеокальцина и степень снижения его концентрации зависит от выраженности рахитического процесса. У больных с гиперкортицизмом и пациентов, получающих преднизолон, значительно снижено содержание остеокальцина в крови, что отражает подавление процессов костеобразования.
Изофермент щелочной фосфатазы присутствует на клеточной поверхности остеобластов. При увеличенном синтезе фермента клетками костной ткани повышается его количество в плазме крови, поэтому определение активности щелочной фосфатазы, особенно костного изофермента, является информативным показателем костного ремоделирования.
Остеопротегерин выступает в качестве рецептора ФНО. Связываясь с преостеокластами, он ингибирует мобилизацию, пролиферацию и активацию остеокластов.
5.4. РЕАКЦИЯ КОСТНОЙ ТКАНИ НА ДЕНТАЛЬНЫЕ
ИМПЛАНТАТЫ
При различных формах адентии альтернативой съёмному протезированию являются внутрикостные дентальные имплантаты. Реакцию костной ткани на имплантат можно рассматривать как частный случай репаративной регенерации.
Различают три вида соединения дентальных имплантатов с костной тканью:
Прямое приживление - остеоинтеграция;
Фиброзно-оссальная интеграция, когда вокруг дентального имплантата образуется слой фиброзной ткани толщиной около 100 мкм;
Периодонтальное соединение (самый редкий вид), образующееся в случае периодонтального связочно-подобного сращения с периимплантационными коллагеновыми волокнами или (в некоторых случаях) цементирование внутрикостного дентального имплантата.
Считают, что в процессе остеоинтеграции после постановки дентальных имплантатов образуется тонкая зона из протеогликанов, которая лишена коллагена. Зона склеивания дентального имплантата с костью обеспечивается двойным слоем протеогликанов, включающим молекулы декорина.
При фиброзно-оссальной интеграции в соединении имплантата с костной тканью также участвуют многочисленные компоненты внеклеточного матрикса. За устойчивость имплантата в его капсуле отвечают коллагены I и III типа, а фибронектин играет основную роль в связывании элементов соединительной ткани с имплантатами.
Однако через какой-то период времени под действием механической нагрузки растёт активность коллагеназы, катепсина К и кислой фосфатазы. Это приводит к убыли костной ткани в периимплантационной области и происходит дезинтеграция дентального имплантата. Ранняя дезинтеграция внутрикостных дентальных имплантатов происходит на фоне сниженного количества в кости фибронектина, Gla-белка, тканевого ингибитора матриксных металлопротеиназ (ТИМП-1).
Вестн. Ом. ун-та. 2015. № 4. С. 39-44.
УДК 54.062, 543.544.5.068.7
С.А. Герк, О.А. Голованова
Проведено сравнительное исследование микро- и макроэлементного состава костных тканей человека в «норме» с содержанием элементов в костных образцах, поврежденных вследствие коксартроза, а также в физиогенных (дентин и эмаль зуба) и в патогенных (слюнные, зубные и почечные камни) биоминералах. Показано, что в «норме» костная ткань по минеральному составу наиболее близка к дентину и к зубным камням. Установлено, что в костных тканях человека при коксартрозе изменяется величина атомного соотношения Са/Р и содержание элементов: меди, олова, железа, марганца, стронция и хрома (в ряде случаев). Выявлена взаимосвязь концентрационных рядов микроэлементов Zn > Sr > Fe пораженной костной ткани с рядами для зубных и почечных камней.
Ключевые слова: элементный состав, физиогенная и патогенная минерализация, кости, коксартроз, спектроскопия. * 2
Введение
Костная ткань относится к высокоспециализированным физиогенным биоминералам и представляет собой биохимическую систему с многокомпонентным составом и сложным строением. Благодаря такой структурной организации данный органо-минеральный агрегат (далее - ОМА) обеспечивает нормальное течение обмена веществ (метаболизма) в организме человека в целом. При этом, находясь в постоянном контакте с биологическими жидкостями, костная ткань является местом депонирования макро- и микроэлементов . Известно, что элементы не синтезируются в организме, а поступают с пищевыми продуктами, водой, воздухом и выполняют важную роль при костном ремоделировании . Так, обобщая литературные данные о роли и степени участия микроэлементов в костеобразовании, их можно разделить на пять групп : 1) активаторы костной минерализации - Cu, Mn, F, Si, V;
2) ингибиторы костной минерализации - Sr, Cd, Be, Fe; 3) активаторы костной резорбции - Mg, Zn, Ba; 4) элементы, принимающие участие в синтезе органических веществ - Zn, Be, Cu, Mn, Si; 5) активаторы костных клеток и ферментов - Mg, Zn, Be и их ингибиторы - Mo. Изменение содержания элементов в костной ткани (избыток или недостаток), прежде всего кальция и фосфора, приводит к нарушению метаболических процессов и является причиной различных костно-суставных заболеваний, патологий зубов и патогенного минералообразования - формирования слюнных, зубных, почечных и других камней . Однако, несмотря на значительное количество работ, в которых описана роль макро- и микроэлементов в физиологических процессах, до сих пор остаются дискуссионными данные по элементному составу костных тканей, в том числе в условиях развития патологии.
Актуальность данной проблемы возрастает и в связи с сохраняющейся сложной экологической обстановкой природных объектов (источников поступления элементов в организм человека) промышленных городов-мегаполисов, а именно: чрезмерным выбросом в атмосферу промышленных отходов, усиленной эксплуатацией почв, нерациональным использованием природных ресурсов и загрязнением водных источников. Так, на сегодняшний день вода многих рек России стала практически не пригодной для питья из-за превышающего ПДК содержания органических веществ синтетического происхождения (СПАВ, ПАУ, диоксины), нефти, нефтепродуктов и солей тяжелых металлов .
Цель работы: изучить особенности элементного состава костной ткани человека в «норме» по сравнению с патогенными ОМА и при костных заболеваниях (на примере коксартроза).
* Работа выполнена при частичной финансовой поддержке совета по грантам Президента Российской Федерации, проект № СП-933.2015.4, Российского фонда фундаментальных исследований (грант № 15-29-04839 офи_м).
© С.А. Герк, О.А. Голованова, 2015
С.А. Герк, О.А. Голованова
Объекты и методы исследования
Работа является продолжением исследования коллекции головок бедренных костей мужчин и женщин Омского региона в возрасте от 30 до 79 лет, удаленных вследствие коксартроза. В качестве контрольных проб костной ткани использованы непораженные образцы, которые извлекались в соответствии с Приказом Министерства здравоохранения СССР от 21 июля 1978 г. № 694 «Об утверждении инструкции о производстве судебно-медицинской экспертизы, положения о бюро судебно-медицинской экспертизы и других нормативных актов по судебно-медицинской экспертизе» (п. 2.24), федеральными законами от 12 января 1996 г. № 8-ФЗ «О погребении и похоронном деле» (п. 3) и от 31 мая 2001 г. № 73-ФЗ «О государственной судебно-экспертной деятельности в Российской Федерации» (п. 14, 16). Для изучения динамики заболевания из бедренных головок получали по три горизонтальных среза: верхний, средний и нижний (порядок чередования приведен в направлении гиалиновый хрящ - бедренная кость), которые в дальнейшем анализировали в виде сухих порошкообразных проб. Усредненный состав разных пораженных пластинок сравнивали между собой и с контрольными образцами.
мощью следующих спектральных методов анализа: ионов кальция - метод атомно-абсорбционной спектроскопии (ААС) на спектрометре AAS 1N по ГОСТ 26570-95 ; общий фосфор - спектрофотометрический метод на автоматизированной линии «Contiflo» (ГОСТ 26657-97) ; остальные элементы -метод масс-спектроскопии с индуктивно-связанной плазмой (ИСП-МС) на спектрофотометре ELAN 9000. Концентрации ионов элементов рассчитывали по градуировочным кривым с использованием стандартных растворов. Пределы обнаружения элементов методами спектрофотомерии и ААС составляли 10-6 масс. %, для ИСП-МС - 10-9 -10--13 масс. %.
Статистическую обработку полученных данных проводили методом Стьюдента для доверительной вероятности Р = 0,95, исходя из предположения об их распределении по нормальному закону (программный пакет Statistic Soft 2006).
Результаты и их обсуждение
Анализ литературных источников показал, что данные по количественному содержанию элементов в костной ткани достаточно противоречивы , что обусловлено спецификой состава разных костей, их типом (табл. 1), возрастными особенностями человека (табл. 2), условиями среды проживания (климат, техногенное воздействие), характером питания и т. д.
Таблица 1
Исследуемая кость Mn Al Си Ti V
Малоберцовая 0,173 ± 0,030 0,113 ± 0,017 0,086 ± 0,030 0,062 ± 0,006 0,006 ± 0,004
Большеберцовая 0,184 ± 0,024 0,106 ± 0,024 0,084 ± 0,022 0,063 ± 0,006 0,006 ± 0,0007
Бедренная 0,220 ± 0,048 0,117 ± 0,034 0,040 ± 0,012 0,078 ± 0,010 0,006 ± 0,001
В среднем 0,192 ± 0,031 0,112 ± 0,016 0,070 ± 0,020 0,068 ± 0,008 0,006 ± 0,001
Таблица 2
Микроэлементы Возраст костной ткани
эмбрионы от 16-17 до 21 недели от одного дня до 19 лет от 20 до 40 лет от 50 до 83 лет
Fe 215,8 146,2 132,8 119,3
Si 23,8 25,3 22,4 16,4
Al 5,96 6,45 7,42 8,09
Pb 4,48 3,03 7,09 1,04
Cu 2,86 1,64 1,42 1,24
Sr 1,27 2,73 1,48 6,78
Ti 1,01 1,13 1,02 1,25
Mn 0,99 1,08 1,17 1,24
Сравнительное исследование литературных и экспериментальных данных позволило установить, что основными макроэлементами кости, содержание которых составляет больше 10-3 % от массы тела, выступают кальций, фосфор, натрий, калий, магний; к элементам с массовым составом от 10-3 до 10-6 % относятся цинк, марганец, медь, никель и другие (табл. 3 и 4). Видно, что физиогенные ОМА (кости, зубы) по макроэлементному составу значительно отличаются от патогенных конкрементов фосфатного типа, встречающихся наиболее часто в
организме человека (зубные, слюнные и почечные камни). Интервал варьирования элементов в костной и зубной ткани более узкий, очевидно, вследствие закономерного характера формирования физиогенных биоминералов и меньшего влияния эндогенных факторов на данный процесс. Условно можно отметить, что костная ткань по минеральному составу (Са, Р, Na, К, Mg) наиболее близка к физиогенному ОМА - дентину и к патогенным биоминералам -зубным камням, что может указывать на сходство составов минералообразующих сред и/или механизмов их образования .
Элементный состав костной ткани человека в норме и при патологии
Таблица 3
Макроэлементный состав физиогенных (костной ткани, эмали и дентина зуба) и патогенных (зубных, слюнных, почечных камней) ОМА фосфатного типа, масс. %
Компонент Костная ткань Эмаль Дентин Зубные камни 9; 25] Слюнные камни Почечные камни г
«норма» при коксартрозе
Ca/P 1,37 1,77 - 0,89 ± 0,04 1,81 ± 0,01 1,63 1,6-1,69 1,61 1,64-1,65 1,49-2,04 1,49-1,79 - 1,67
Na 0,70 0,90 0,50 0,44 ± 0,02 0,46 ± 0,14 0,50-0,90 0,25-0,90 0,60 0,7 0,37-0,88 0,28-0,95 0,1-2,43 -
Mg 0,55 0,72 0,30 0,19 ± 0,007 0,22 ± 0,01 0,07-0,44 0,25-0,56 1,23 0,8-1,0 0,32-0,50 0,20-0,24 1,5-84,58 -
K 0,03 0,03 0,20 0,058 ± 0,013 0,028 ± 0,013 0,001-0,008 0,05-0,30 0,05 0,02-0,04 0,11-0,13 0,03-0,12 0,07-4,05 -
Примечание: «-» - данные отсутствуют.
Таблица 4
Элементный состав физиогенных (костной ткани, эмали, дентина зуба) и патогенных (зубных, слюнных, почечных камней) ОМА фосфатного типа, -10-4 масс. %
Элемент Костная ткань Эмаль Дентин Зубные камни Слюнные камни Почечные камни
1; . Возможно, доминирующей заменой ионов в структуре костного апатита в данном случае является анионное замещение фосфатных тетраэдров, что является одной из причин снижения окристалли-зованности гидроксилапатита костных тканей .
Как и в случае макроэлементного состава, содержание микроэлементов в костной ткани значительно отличается от патогенных ОМА (табл. 4). В состав патогенных биоминералов входит наибольшее число микроэлементов, что в очередной раз подтвер-
ждает спонтанный и физиологически неконтролируемый механизм их образования. Все элементы в патогенных конкрементах содержатся в меньшем количестве, чем в костях. В отличие от других физиогенных минералов, костная ткань по содержанию Pb, Si, Zn, Sr, Ag уступает только эмали. При этом в ней содержится больше меди (в 13 раз) и бария (в 5 раз). По сравнению с дентином данный биоминерал наиболее богат практически всеми микроэлементами, за исключением цинка и серебра.
Ряды ранжирования микроэлементов, содержание которых составляет 0,0050,2 масс. %, по увеличению их концентраций выглядят следующим образом (табл. 4) : для костной ткани - Fe > > Cu > Ba > Pb > Si > Zn > Sr > Ni > Al > Mn; зубных камней - Zn > Sr > Fe > Ti > Cr; для слюнных камней - Ti > V > Cr > Fe > I; для почечных камней - Sr > Zn > Fe. Видно, что по сравнению с костной тканью в патогенных биоминералах число элементов в ряду, содержание которых в ОМА не менее 0,005 масс. %, уменьшается в 2 раза (для слюнных и зубных камней) и в 3 раза (для почечных камней). Остальные элементы в патогенных агрегатах представлены в меньшем количестве, чем в кости. Во всех рядах присутствует железо, в почечных и зубных образованиях в больших количествах содержится также Sr и Zn, а в слюнных и почечных появляются новые элементы Cr и Ti. Приведенные данные указывают на разную степень участия элементов в патогенной и физиогенной минерализации. Первостепенная роль в минерализации разного характера принадлежит железу, стронцию и цинку. В патогенных ОМА принимают участие микроэлементы, такие как Cr и Ti.
Головки бедренных костей исследуемой нами коллекции, в отличие от литературных данных, содержат микроэлементы в малых количествах (табл. 4). Так, концентрационные ряды элементов, содержание которых превышает 0,005 масс. %, состоят из двух и трех элементов: в «норме» - Zn > Sr и при коксартрозе - Zn > Sr > Fe. Такая последовательность элементов при повреждении костной ткани коррелирует с рядами для зубных и почечных камней, что может указывать на патологическое течение процесса минерализации костной ткани при коксартрозе.
Выявлено, что в пораженных верхних срезах костных тканей лиц первой и второй возрастных групп (30-49 и 50-59 лет) по сравнению с контрольными пробами повышено содержание ионов меди в 3 раза, олова в 4 раза, железа в 11 раз, марганца в 17 раз и хрома (в ряде образцов) в 18 раз (рис. 2). Также в отличие от «нормы» в поврежденных пробах можно отметить незначительное уменьшение количества ионов стронция.
Элементный состав костной ткани человека в норме и при патологии
Следовательно, полученные результаты свидетельствуют о нарушении процессов костного ремоделирования при коксартрозе. С одной стороны, возрастает содержание элементов, оказывающих активирующее действие на костную минерализацию (Cu и Mn), с другой, изменяется количество микроэлементов, ускоряющих скорость костной резорбции (Fe и Sn). Завышенные концентрации токсичного элемента хрома в ряде образцов также указывают на разрушающий (дегенеративный) характер метаболизма при данном заболевании. Роль олова в костном обмене в настоящее время не изучена.
В образцах костных тканей лиц третьей и четвертой категорий (60-69 и 70-79 лет) определенных закономерностей по изменению содержания микроэлементов при патологии установить не удалось, что может быть связано с процессами старения костной ткани и наличием сопутствующих заболеваний в данном возрастном интервале.
Таким образом, в работе установлено, что при заболеваниях, обусловленных нарушением Са/Р обмена веществ, таких как коксартроз, в костных тканях человека изменяется содержание следующих элементов: меди, олова, железа, марганца, стронция и хрома (в ряде случаев). При данном повреждении выявлено увеличение значения Са/Р-коэффициента, в основном за счет уменьшения содержания общего фосфора.
В состав костной ткани, в отличие от патогенных ОМА, входит меньшее количество микроэлементов, содержание которых зависит от степени минерализации костного об-
разца. Выявлена взаимосвязь концентрационных рядов микроэлементов Zn > Sr > Fe пораженной костной ткани с рядами для зубных и почечных камней, что может указывать на патологическое течение костной минерализации.
Показано, что в условиях физиологической «нормы» костная ткань по минеральному составу наиболее близка к физиогенному ОМА - дентину и к патогенным биоминералам - зубным камням.
Полученные данные могут быть использованы при изучении процессов костной минерализации в модельных условиях с целью разработки эффективных лечебных и профилактических методов восстановления костных тканей при костно-суставных заболеваниях.
ЛИТЕРАТУРА
Авицын А. П., Жаворонков А. А., Риш М. А., Строчкова Л. С. Микроэлементы человека. М., 1991. 496 с.
Зацепин С.Т. Костная патология взрослых. М., 2001. 640 с.
Лунева С. Н. Биохимические изменения в тканях суставов при дегенеративно-дистрофических заболеваниях и способы биологической коррекции: дис. ... д-ра биол. наук. Тюмень, 2003. 297 с.
Ерохин А. Н., Исаков Б. Д., Накоскин А. Н. Особенности микроэлементного состава костной ткани при чрескостном дистракционном остеосинтезе методом Илизарова в условиях высокогорья (экспериментальное исследование) // Саратовский научно-медицинский журнал.
2014. № 10 (1). С. 119-123.
Новиков М. И. Динамика накопления биогенных макро- и микроэлементов в костной ткани собак в постнатальном онтогенезе и в условиях чрескостного дистракционного остеосинтеза: дис. ... канд. биол. наук. Н. Новгород, 2008. 137 с.
Лемешева С. А. Химический состав, свойства костного апатита и его аналогов: дис. ... канд. хим. наук. М., 2010. 177 с.
Прохончуков А. А., Жижина Н. А., Тигранян Р. А. Гомеостаз костной ткани в норме и при экстремальных условиях. М., 1984. 200 с.
Голованова О. А., Борбат В. Ф. Почечные камни. М., 2005. 171 с.
Голованова О. А. Биоминералогия мочевых, желчных, зубных и слюнных камней из организма человека: дис. ... д-ра геол.-минерал. наук. Томск, 2009. 240 с.
Александрова Т. В., Нахаева В. И. Генотоксический анализ водных проб естественного источника питьевой воды из реки Омь на генные и хромосомные мутации // Современные проблемы науки и образования. 2014. № 6. URL: http://www.science-education.ru/120-15369.
ГОСТ 26570-95. Корма, комбикорма, комбикормовое сырье. Методы определения кальция. М., 2000.
ГОСТ 26657-97. Корма, комбикорма, комбикормовое сырьё. Метод определения содержания фосфора. М., 2000.
С.А. Герк, О.А. Голованова
Накоскин А. Н. Возрастные изменения и половые различия биохимического состава костной ткани человека: дис. ... канд. биол. наук. Курган, 2004. 111 с.
Lundager Madsen H. E., Abbona F., Barrese E. Effects of cadmium on crystallization of calcium phosphates // Crystal Research and Crystal Technology. 2004. Vol. 39. № 3. P. 235-239.
Войнар А. О. Значение микроэлементов в организме человека и животных. М., 1955. 24 с.
Энока P. M. Основы кинезиологии: пер. с англ. Киев: Олимпийская литература, 1998. 399 с.
Гилинская Л. Г., Занин Ю. Н., Назьмов В. П. Типоморфизм парамагнитных радикалов CO2-, CO3- и CO33- в природных карбонатапатитах // Геология и геофизика. 2002. T. 43. № 3. С. 297303.
Матвеева Е. Л. Биохимические изменения в синовиальной жидкости при развитии дегенеративно-дистрофических процессов в коленном суставе: автореф. дис. ... д-ра биол. наук. Тюмень, 2007. 24 с.
Вербова А. Ф. Состояние костной ткани и кальций-фосфорного обмена у рабочих фосфорного производства // Казанский медицинский журнал. 2002. Т. 83. № 2. С. 148-150.
Ньюман У, Ньюман М. Минеральный обмен кости / пер. с англ. О. Я. Терещенко, Л. Т. Туточ-киной; под ред. Н. Н. Демина. М., 1961.270 с.
Legeros R. Z. Calcium phosphates in oral biology and medicine. Karger, 1991. 221 p.
Корж А. А, Белоус А. М., Панов Е. Я. Репаративная регенерация кости. М., 1972. 215 с.
Пилат Т. Л. Зубной камень и его влияние на ткани пародонта // Стоматология. 1984. № 3. С. 88-90.
Ткаленко А. Ф. Влияние физико-химических характеристик слюны, слюнных и зубных отложений на исход лечения больных слюннокаменной болезнью: автореф. дис. . канд. мед. наук. М., 2004. 26 с.
Киселева Д. В. Особенности состава, структуры и свойств ряда фосфатных и карбонатных биоминералообразований: дис. ... геол.-минерал. наук. Екатеринбург, 2007. 197 с.
LeGeros R. Z. Formation and transformation of calcium phosphates: relevance to vascular calcification // Zeitschrift fur Kardiologie. 2001. Supplement Band 90. Р. 116-124.
Смолеговский А. М. История кристаллохимии фосфатов. М., 1986. 263 с.
Баринов С. М., Комлев В. С. Биокерамика на основе фосфатов кальция. М., 2005. 204 с.
Christoffersen M. R., Seierby N., Zunic T. B., Chris-toffersen J. Kinetics of dissolution of triclinic calcium pyrophosphate dehydrate crystals // Journal of Crystal Growth. 1999. Vol. 203. Р. 234-243.
 Ударение в английском языке
Ударение в английском языке 10 слов с ударением на 1 слог
10 слов с ударением на 1 слог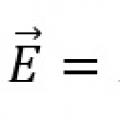 Закон Ома для замкнутой цепи и неоднородного участка цепи
Закон Ома для замкнутой цепи и неоднородного участка цепи