Адиабатный процесс pv и ts диаграммы. Рабочая диаграмма P-V. Работа расширения и полезная работа газа. г) Адиабатный процесс
Внутренняя энергия.
Внутренняя энергия включает в себя:
1 кинетическую энергию поступательного, вращательного и колебательного движения частиц.
2 потенциальную энергию взаимодействия частиц.
3 энергию электронных оболочек.
4 внутриядерную энергию.
Т.к. в большинстве случаев 3 и 4 являются постоянными, то в дальнейшем под внутренней энергией будем понимать энергию хаотического движения молекул и атомов. Для реальных газов необходимо учитывать потенциальную энергию. Поэтому внутренняя энергия есть некоторая однозначная функция состояния тела, т.е. любых двух независимых параметров.
U=f(P,T); U=f(υ,P); U= f(υ,T).
Изменение внутренней энергии не зависит от характера процесса, а определяет только начальное и конечное состояние тела.
Внутренняя энергия идеального газа, в которой отсутствуют силы межмолекулярного взаимодействия не зависит от V тела или Р, а определяется только конечной температурой
А для реального нужно учитывать все силы.
Для идеального газа 
 Рис. 3. Изменение внутренней энергии идеального газа.
Рис. 3. Изменение внутренней энергии идеального газа.
ΔU=U 2 -U 1 = U 21 -U 11 = U 2’ -U 1’ (26)
ΔU=f(T 2)-f(T 1) (27).
Работа газа.
Рабочая диаграмма P-V. Работа расширения и полезная работа газа.
Передача энергии от одного тела к другому, связанная с изменением объема рабочего тела, с перемещением его во внешнем пространстве или с изменением его положения называется работой. В этом процессе участвуют два или более тел. 1-ое тело, производящее работу – отдает энергию; 2– ое тело получает энергию. Совершенная газом работа зависит от p, V, T.
Рассмотрим частный случай: работа расширения 1кг газа в равновесном процессе при постоянном давлении. Давление рабочего тела равно давлению окружающей среды.
Pdf – сила, действующая на поршень
Элементарная работа
Работа dl=p·df·dS (28).

Работа l, совершаемая системой при конечном изменении объема от V 1 до V 2 в произвольном равновесном процессе. 
В реальном произвольном процессе р≠const и изменяется с изменением удельного объема υ, т.е. является функцией объема p=f(υ)


Рисунок 5. Рисунок 6.
Из рисунка 5 видно, что S 1,2,3,4 под процессом 1- 2 = работе расширения l, что следует из уравнения 30. Графическое представление процесса в координатах p-υ называется рабочей диаграммой (рис.5).
Если процесс осуществляется в направлении 1→2, это работа расширения, она положительна, т.к. dυ>0, совершается самой системой и оценивается площадью 1234.под линией процесса
1®2 dv>0 “+ l ” (1234).
Если наоборот, процесс протекает в направлении 2®1, то dυ<0, работа отрицательна (работа сжатия), затрачивается извне и оценивается площадью 4321под линией процесса
2®1 dv<0 “-l ” (4321).
Работа в отличие от изменения внутренней энергии зависит от характера процесса. Рассмотрим 3 процесса совершения работы по а,в и с (Рис.6). Они начинаются состоянием 1(р 1 ,v 1 ,т 1) и заканчиваются состоянием 2 (р 2 ,v 2 ,т 2), но промежуточные состояния различны. Изменение внутренней энергии для всех 3 процессов одинаково
ΔU = ΔU A = ΔU В = ΔU С,
А работа различна
L А > L В > L С.
Встречаются случаи, когда в рабочем теле изменяется внешняя кинетическая энергия без изменения объема (например, перемешиание мешалками). В таком процессе
 , т.к. (31)
, т.к. (31)
Работа в термодинамике, так же как и в механике, определяется произведением действующей на рабочее тело силы на путь ее действия. Рассмотрим газ массой М и объемом V , заключенный в эластичную оболочку с поверхностью F (рисунок 2.1). Если газу сообщить некоторое количество теплоты, то он будет расширяться, совершая при этом работу против внешнего давления р , оказываемого на него средой. Газ действует на каждый элемент оболочки dF с силой, равной pdF и, перемещая ее по нормали к поверхности на расстояние dn , совершает элементарную работу pdFdn .
Рис. 2.1 – К определению работы расширения
Общую работу, совершенную в течение бесконечно малого процесса, получим, интегрируя данное выражение по всей поверхности F оболочки:
![]() .
.
Из рисунок 2.1 видно, что изменение объема dV
выражается в виде интеграла по поверхности: ![]() , следовательно
, следовательно
δL = pdV. (2.14)
При конечном изменении объема работа против сил внешнего давления, называемая работой расширения, равна
Из (2.14) следует, что δL и dV всегда имеют одинаковые знаки:
если dV > 0, то и δL > 0, т.е. при расширении работа тела положительна, при этом тело само совершает работу;
если же dV < 0, то и δL< 0, т. е. при сжатии работа тела отрицательна: это означает, что не тело совершает работу, а на его сжатие затрачивается работа извне.
Единицей измерения работы в СИ является джоуль (Дж).
Отнеся работу расширения к 1 кг массы рабочего тела, получим
l = L/M; δl = δL/М = pdV/M = pd(V/M) = pdv. (2.16)
Величина l, представляющая собой удельную работу, совершаемую системой, содержащей 1 кг газа, равна
Поскольку в общем случае р – величина переменная, то интегрирование возможно лишь тогда, когда известен закон изменения давления p = p(v).
Формулы (2.14) – (2.16) справедливы только для равновесных процессов, при которых давление рабочего тела равно давлению окружающей среды.
В термодинамике для исследования равновесных процессов широко используют рv – диаграмму, в которой осью абсцисс служит удельный объем, а осью ординат – давление. Поскольку состояние термодинамической системы определяется двумя параметрами, то на рv – диаграмме оно изображается точкой. На рисунке 2.2 точка 1 соответствует начальному состоянию системы, точка 2 – конечному, а линия 12 – процессу расширения рабочего тела от v 1 до v 2 .
При бесконечно малом изменении объема dv площадь заштрихованной вертикальной полоски равна pdv = δl, следовательно, работа процесса 12 изображается площадью, ограниченной кривой процесса, осью абсцисс и крайними ординатами. Таким образом, работа изменения объема эквивалентна площади под кривой процесса в диаграмме рv .

Рис. 2.2 – Графическое изображение работы в рv – координтах
Каждому пути перехода системы из состояния 1 в состояние 2 (например, 12, 1а2 или 1b2) соответствует своя работа расширения: l 1 b 2 >l 1 a 2 >l 12 Следовательно, работа зависит от характера термодинамического процесса, а не является функцией только исходного и конечного состояний системы. С другой стороны, ∫pdv зависит от пути интегрирования и, следовательно, элементарная работа δl не является полным дифференциалом.
Работа всегда связана с перемещением макроскопических тел в пространстве, например перемещением поршня, деформацией оболочки, поэтому она характеризует упорядоченную (макрофизическую) форму передачи энергии от одного тела к другому и является мерой переданной энергии.
Поскольку величина δl пропорциональна увеличению объема, то в качестве рабочих тел, предназначенных для преобразования тепловой энергии в механическую, целесообразно выбирать такие, которые обладают способностью значительно увеличивать свой объем. Этим качеством обладают газы и пары жидкостей. Поэтому, например, на тепловых электрических станциях рабочим телом служат пары воды, а в двигателях внутреннего сгорания – газообразные продукты сгорания того или иного топлива.
2.4 Работа и теплота
Выше отмечалось, что при взаимодействии термодинамической системы с окружающей средой происходит обмен энергией, причем один из способов ее передачи – работа, а другой – теплота.
Хотя работа L и количество теплоты Q имеют размерность энергии, они не являются видами энергии. В отличие от энергии, которая является параметром состояния системы, работа и теплота зависят от пути перехода системы от одного состояния в другое. Они представляют две формы передачи энергии от одной системы (или тела) к другой.
В первом случае имеет место макрофизическая форма обмена энергией, которая обусловлена механическим воздействием одной системы на другую, сопровождаемым видимым перемещением другого тела (например, поршня в цилиндре двигателя).
Во втором случае осуществлена микрофизическая (т.е. на молекулярном уровне) форма передачи энергии. Мера количества переданной энергии – количество теплоты. Таким образом, работа и теплота – энергетические характеристики процессов механического и теплового взаимодействия системы с окружающей средой. Эти два способа передачи энергии эквивалентны, что вытекает из закона сохранения энергии, но неравноценны. Работа может непосредственно преобразовываться в теплоту – одно тело передает при тепловом контакте энергию другому. Количество же теплоты Q непосредственно расходуется только на изменение внутренней, энергии системы. При превращении теплоты в работу от одного тела – источника теплоты (ИТ) теплота передается другому – рабочему телу (РТ), а от него энергия в виде работы передается третьему телу – объекту работы (ОР).
Следует подчеркнуть, что если мы записываем уравнение термодинамики, то входящие в уравнения L и Q означают энергию, полученную соответственно макро– или микрофизическим способом.
Изопроцессами называются процессы, протекающие при неизменном значении одного из па-раметров: давления (p ) , объема (V ) , температуры (T ).
Изопроцессами в газах являются термодинамические процессы, на протяжении течения которых количество вещества и давление, объём, температура либо энтропия не поддаются изменениям. Таким образом, при изобарном процессе не изменяется давление, при изохорном - объём, при изотермическом - температура, при изоэнтропийном - энтропия (к примеру, обратимый адиабатический процесс). И линии, которые отображают перечисленные процессы на некой термодинамической диаграмме, называют, соответственно, изобара , изохора , изотерма и адиабата . Все эти изопроцессы являются частными случаями политропного процесса.
Изохорный процесс.
Изохорный (или изохорический ) процесс — это изменение термодинамической системы с условием не изменения объема (V = const ). Изохорой называют линию, которая отображает изохорический процесс на графике. Этот процесс описывает закон Шарля.
Изотермический процесс.
Изотермический процесс — это изменение термодинамической системы с условием не изменения температуры (T = const ). Изотермой называют линию, которая отображает изотермический процесс на графике. Этот процесс описывает закон Бойля-Мариотта.
Изоэнтропийный процесс.
Изоэнтропийный процесс — это изменение термодинамической системы с условием не изменения энтропии (S = const ). Изоэнтропийным является, например, обратимый адиабатический процесс: в таком процессе не происходит теплообмена с окружающей средой. Идеальный газ в таком процессе описывается следующим уравнением:
pV γ = const ,
где γ — показатель адиабаты, определяемый типом газа.
РЕАЛЬНЫЕ ГАЗЫ
ЛЕКЦИЯ 7
Сопло Лаваля
Проведенный анализ касался течения газа через суживающееся сопло. Из него не следует делать вывод о том, что вообще не возможно, например, при адиабатном течении получить скорость потока выше звуковой.
Как следует из уравнения (10.1), для перехода в область сверхзвуковых скоростей необходимо иметь расширяющийся канал. Следовательно, дополняя суживающийса канал, где газ достигает критической скорости, расширяющимся, мы предоставляем газу возможность продолжить свое расширение и приобрести сверхзвуковую скорость. Такое комбинированное сопло называется соплом Лаваля (рис. 4).
Сопло Лаваля целесообразно применять лишь при . Скорость истечения, например, при адиабатном течении определится с помощью уравнения (14). Расход определится по минимальному сечению, где имеет место кризис течения. Для этого используется уравнение для определения , в которое следует подставлять вместо f минимальное сечение сопла f min .
В ряде случаев приходится иметь дело с системами, состояние которых не позволяет использовать модель идеального газа. В качестве примера можно назвать водяной пар в тех состояниях, при которых он используется в паросиловых установках.
Здесь приходится принимать во внимание, что молекулы имеют определенные размеры и между ними существуют силы взаимодействия: притяжение при сравнительно больших расстояниях между молекулами и отталкивание при сближении молекул на малые расстояния.
Модель реального газа представляется в виде твердых шариков диаметром d 0 , взаимно притягивающихся друг к другу.
Как видно, модель реального газа отличается от модели идеального газа, во-первых, тем, что сами молекулы имеют некоторый объем, во-вторых, наличием сил межмолекулярного сцепления.
В общем случае, это приводит к тому, что в отличие от идеального газа
и при T = const
Устройство pv – диаграммы реального газа
Впервые подробное экспериментальное исследование зависимости p от v в разных изотермических процессах сжатия реального газа провел на углекислоте в 1857 – 1969 г.г. английский физик Эндрюс. Результаты его экспериментов показаны на рис. 1.
Как видно, при температурах, меньших , изотермическое сжатие углекислоты (СО 2) вначале сопровождается ростом давления. В точке а начинается процесс конденсации. Состояние, отвечающее этой точке, называют сухим насыщенным паром . При продолжении изотермического сжатия давление остается постоянным, а уменьшение объема сопровождается тем, что все большее количество пара превращается в жидкость.
Наконец, в точке b конденсация завершается, и рабочее тело представляет собой кипящую жидкость. На участке ab одновременно существует и жидкая и газообразная фазы. Состояния, характеризуемые точками на ab , называют влажным насыщенным паром .
Соотношение между паровой и жидкой фазой характеризуют степенью сухости пара - это массовая доля сухого насыщенного пара во влажном. Степень сухости пара определяется выражением
где m n и m ж – соответственно масса пара и жидкости во влажном насыщенном паре.
Удельный объем сухого насыщенного пара обозначают (точка а ), а кипящей жидкости – (точка b ).

Рис. 1. PV – диаграмма реального газа
При продолжении изотермического сжатия в области v < v" отмечается резкое возрастание давления, так как жидкость обладает малой сжимаемостью.
С ростом температуры разность (v" - v" ), быстро убывает за счет интенсивного уменьшения v" и некоторого роста v" , т.е. с ростом температуры уменьшается разница между плотностями жидкой и газовой фаз.
Уменьшение (v" - v" ) продолжается вплоть до температуры Т кр , когда эта разность обращается в нуль (точка К ), т.е. в этой точке исчезает различие между плотностями жидкости и пара. Точка К , отвечающая этому состоянию, называется критической точкой . Соответственно давление, температура и удельный объем называются критическими (р кр, Т кр, v кр ). Естественно, что все попытки обеспечить путем изотермического сжатия сжижение газа при Т > Т кр , обречены на неудачу.
Критической температуре можно дать молекулярно-кинетическое толкование. Объединение свободнодвижущихся молекул в каплю, жидкости при сжижении газа происходит исключительно под действием сил взаимного притяжения. Этому препятствует кинетическая энергия движения молекул, равная с среднем kT (k – постоянная Больцмана). Очевидно, объединение молекул в каплю может произойти лишь при том условии, что кинетическая энергия движения молекул, пропорциональная Т , меньше или равна потенциальной энергии из взаимного притяжения (u o ). Если кинетическая энергия больше потенциальной энергии взаимного притяжения, то конденсация жидкости при изотермическом сжатии не сможет произойти. Сопоставление этих положений с результатом анализа диаграммы Эндрюса позволяет сделать вывод о том, что Т кр – температура, соответствующая равенству указанных энергий
Если , то и конденсация при изотермическом сжатии возможна.
Если , то и конденсация при изотермическом сжатии не возможна.
1. Область левее нижней пограничной кривой KI – это область некипящей жидкости.
2. Линия KI - это геометрическое место точек начала парообразования или конца конденсации. Иначе эту линию называют нижняя пограничная кривая . Степень сухости на нижней пограничной кривой равняется нулю (x = 0 ), а состояние вещества кипящая жидкость.
3. Область между KI и KII - область влажного насыщенного пара.
Это смесь сухого насыщенного пара с каплями жидкости (туманообразное состояние). Это двухфазное состояние.
Для того чтобы превратить 1 кг жидкости в пар, надо сообщить ей какое-то количество теплоты. Эту величину называют удельной теплотой парообразования r , кДж/кг.
4. Линия KII - это геометрическое место точек конца парообразования или начала конденсации. Линию KII иначе называют верхняя пограничная кривая . Степень сухости на верхней пограничной кривой равняется единице (x = 1 ), а состояние вещества сухой насыщенный пар .
Насыщенный пар - это пар, находящийся в динамическом равновесии с жидкостью.
5. Точка К - критическая точка.
6. Область правее и выше верхней пограничной кривой – это область перегретого пара.
Фазовая pv – диаграмма системы, состоящей из жидкости и пара, представляет собой график зависимости удельных объёмов воды и пара от давления.
Пусть вода при температуре 0 0 С и некотором давлении ρ занимает удельный объём v 0 (отрезок NS) . Вся кривая АЕ выражает зависимость удельного объёма воды от давления при температуре 0 0 С . Т.к. вода вещество почти несжимаемое то кривая АЕ почти параллельна оси ординат. Если при постоянном давлении сообщать воде теплоту, то её температура будет повышаться и удельный объём увеличиваться. При некоторой температуре t s вода закипает, а её удельный объём v’ в точке А’ достигнет при данном давлении максимального значения. С увеличением давления растёт температура кипящей жидкости t s и объём v’ также увеличивается. График зависимости v’ от давления представлен кривой АК которая называется пограничной кривой жидкости. Характеристикой кривой является степень сухости x=0 . В случае дальнейшего подвода теплоты при постоянном давлении начнётся процесс парообразования. При этом количество воды уменьшается, количество пара увеличивается. В момент окончания парообразования в точке В’ пар будет сухим насыщенным. Удельный объём сухого насыщенного пара обозначается v’’ .
Если процесс парообразования протекает при постоянном давлении то температура его не изменяется и процесс A’B’ является одновременно изобарным и изотермическим. В точках A’ и B’ вещество находится в однофазном состоянии. В промежуточных точках вещество состоит из смеси воды и пара. Такую смесь тел называют двухфазной системой .
График зависимости удельного объёма v’’ от давления представлен кривой КВ, которая называется пограничной кривой пара.
Если к сухому насыщенному пару подводить теплоту при постоянном давлении, то температура и объём его будут увеличиваться и пар из сухого насыщенного перейдёт в перегретый (точка D ). Обе кривые АК и КВ делят диаграмму на три части. Влево от пограничной кривой жидкости АК до нулевой изотермы располагается область жидкости. Между кривыми АК и КВ располагается двухфазная система, состоящая из смеси воды и сухого пара. Вправо от КВ и вверх от точки К располагается область перегретого пара или газообразного состояния тела. Обе кривые АК и КВ сходятся в одной точке К , называемой критической точкой.
Критическая точка является конечной точкой фазового перехода жидкость – пар, начинающегося в тройной точке. Выше критической точки существование вещества в двухфазном состоянии невозможно. Никаким давлением нельзя перевести газ в жидкое состояние притемпературах выше критической.
Параметры критической точки для воды:
t к =374,12 0 С; v к =0,003147 м 3 /кг;
ρ к =22,115 МПа; i к =2095,2 кДж/кг
s к =4,424 кДж/(кг·К).
Процесс p =const p – V , i – S и T –S диаграммах.

На is – диаграмме изобара в области насыщенного пара представляется прямой линией, пересекающей пограничные кривые жидкости пара. При подводе теплоты к влажному пару степень сухости его увеличивается и он (при постоянной температуре) переходит в сухой, а при дальнейшем подводе теплоты – в перегретый пар. Изобара в области перегретого пара представляет собой кривую, направленную выпуклостью вниз.

На pv – диаграмме изобарный процесс изображается отрезком горизонтальной прямой, который в области влажного пара изображает и изотермический процесс одновременно.

На Ts – диаграмме в области влажного пара изобара изображается прямой горизонтальной линией, а в области перегретого пара – кривой, обращённой выпуклостью вниз. Значения всех необходимых величин для расчёта берутся из таблиц насыщенных и перегретых паров.
Изменение удельной внутренней энергии пара:
Внешняя работа:
Подведённое удельное количество теплоты:
В том случае, когда q задано и требуется найти параметры второй точки, лежащей в области двухфазных состояний, применяется формула для энтальпии влажного пара:
Процесс T=const водяного пара. Изображение процесса в p – V , i – S и T –S диаграммах.
Изотермический процесс.

На is – диаграмме в области влажного пара изотерма совпадает с изобарой и является прямой наклонной линией. В области перегретого пара изотерма изображается кривой с выпуклостью вверх.
 10 слов с ударением на 1 слог
10 слов с ударением на 1 слог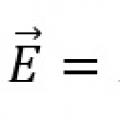 Закон Ома для замкнутой цепи и неоднородного участка цепи
Закон Ома для замкнутой цепи и неоднородного участка цепи Чиновники-академики уволены с госслужбы
Чиновники-академики уволены с госслужбы