Химические реакции альдегидов. Предельные альдегиды и кетоны
Для которых характерна двойная связь между углеродным и кислородным атомами и две одинарные связи этого же атома углерода с углеводородным радикалом, обозначаемым буквой R, и атомом водорода. Группа атомов >С=О называется карбонильной группой, она характерна для всех альдегидов. Многие альдегиды имеют приятный запах. Они могут быть получены из спиртов путем дегидрирования (удаление водорода), благодаря чему получили общее название — альдегиды. Свойства альдегидов определяются наличием карбонильной группы, ее расположением в молекуле, а также длиной и пространственной разветвленностью углеводородного радикала. То есть, зная название вещества, отражающего его можно ожидать определенные химические, а также физические свойства альдегидов.
Есть два основных способа именования альдегидов. Первый метод основан на системе, используемой Международным союзом (IUPAC), его часто называют систематическая номенклатура. Он основывается на том, что самая длинная цепочка, в которой к атому углерода присоединена карбонильная группа, служит основой названия альдегида, то есть его название происходит от названия родственного алкана благодаря замене суффикса -ан на суффикс -аль (метан — матаналь, этан — этаналь, пропан — пропаналь, бутан — бутаналь и так далее). Другой метод образования названия альдегидов использует наименование соответствующей в которую в результате окисления тот превратится (метаналь — альдегид муравьиный, этаналь — альдегид уксусный, пропаналь — альдегид пропионовый, бутаналь — альдегид масляный и так далее).
Именно полярность группы >С=О влияет на физические свойства альдегидов: кипения, растворимость, дипольный момент. Углеводородные соединения, состоящие только из атомов водорода и углерода, плавятся и кипят при низких температурах. У веществ с карбонильной группой они значительно выше. Например, бутан (CH3CH2CH2CH3), пропаналь (CH3CH2CHO) и ацетон (CH3СОСН3) имеют одинаковую молекулярную массу, равную 58, а температура кипения у бутана равняется 0 °C, в то время как для пропаналя она составляет 49 °С, а у ацетона равна 56 °C. Причина большой разницы заключается в том, что полярные молекулы имеют больше возможности друг к другу притягиваться, чем неполярные молекулы, поэтому для их разрыва необходимо больше энергии и, следовательно, требуется более высокая температура, чтобы эти соединения плавились или кипели.
С ростом меняются физические свойства альдегидов. Формальдегид (HCHO) является газообразным веществом при нормальных условиях, ацетальдегид (CH3CHO) кипит при комнатной температуре. Другие альдегиды (за исключением представителей с высоким молекулярным весом) при нормальных условиях являются жидкостями. Полярные молекулы не смешиваются легко с неполярными, потому что полярные молекулы друг к другу притягиваются, и неполярные не в состоянии протиснуться между ними. Поэтому углеводороды не растворяются в воде, так как молекулы воды полярны. Альдегиды, в молекулах которых число атомов углерода менее 5, растворяются в воде, но если число углеродных атомов больше 5, растворение не происходит. Хорошая растворимость альдегидов с низким молекулярным весом обусловлена образованием водородных связей между атомом водорода молекулы воды и атомом кислорода карбонильной группы.
Полярность молекул, образованных различными атомами, может быть количественно выражена числом, называемым дипольным моментом. Молекулы, образованные одинаковыми атомами, не являются полярными и дипольного момента не имеют. Вектор дипольного момента направлен в сторону элемента, стоящего в таблице Менделеева (для одного периода) правее. Если молекула состоит из атомов одной подгруппы, то электронная плотность будет смещаться в сторону элемента с меньшим порядковым номером. Большинство углеводородов не имеют дипольного момента или величина его чрезвычайно мала, но для альдегидов она гораздо выше, что также объясняет физические свойства альдегидов.
Первая группа свойств реакции присоединения. В карбонильной группе между углеродом и кислородом присутствует двойная связь, которая, как вы помните, состоит из сигма-связи и пи-связи. В реакциях присоединения пи-связь рвется и образуются две сигма связи одна с углеродом, вторая с кислородом. На углероде сосредоточен частичный положительный заряд, на кислороде частичный отрицательный. Поэтому к углероду присоединяется отрицательно заряженная частица реагента, анион, а к кислород положительно заряженная часть молекулы.
Первое свойство гидрирование, присоединение водорода.
Реакция проходит при нагревании. Применяется уже известный вам катализатор гидрирования никель. Из альдегидов получаются первичные спирты, из кетонов вторичные.
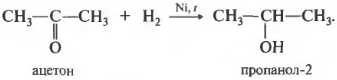
У вторичных спиртов гидроксогруппа связана со вторичным атомом углерода.
Второе свойство гидратация, присоединение воды. Эта реакция возможна только для формальдегида и ацетальдегида. Кетоны совсем не реагируют с водой.

Все реакции присоединения идут таким образом, что плюс идет к минусу, а минус к плюсу.
Как вы помните из видео про спирты , наличие двух гидроксогрупп у одного атома почти невозможная ситуация, такие вещества крайне неустойчивы. Так вот конкретно два этих случая гидрат формальдегида и уксусного альдегида возможны, хотя и существуют только в растворе.
Сами реакции знать не обязательно. Скорее всего, вопрос на экзамене может звучать как констатация факта, допустим, с водой реагируют и перечислены вещества. Среди их перечня которых могут быть метаналь или этаналь.
Третье свойство присоединение синильной кислоты.

Снова плюс идет к минусу, а минус к плюсу. Получаются вещества, называемые гидроксинитрилами. Опять же, сама реакция встречается нечасто, но знать об этом свойстве нужно.
Четвертое свойство присоединение спиртов.
Здесь снова не нужно знать наизусть уравнение реакции, просто надо понимать, что такое взаимодействие возможно.

Как обычно в реакциях присоединения к карбонильной группе плюс к минусу, а минус к плюсу.
Пятое свойство реакция с гидросульфитом натрия.

И снова, реакция довольно сложная, выучить ее вряд ли получится, но это одна из качественных реакций на альдегиды, потому что полученная натриевая соль выпадает в осадок. То есть по факту вы должны знать, что альдегиды реагируют с гидросульфитом натрия, этого будет достаточно.
На этом закончим с первой группой реакций. Вторая группа реакции полимеризации и поликонденсации.
2. Полимеризация и поликонденсация альдегидов
С полимеризацией вы знакомы: полиэтилен, бутадиеновый и изопреновый каучуки, поливинилхлорид это продукты объединения множества молекул (мономеров) в одну большую, в единую полимерную цепь. То есть получается один продукт. При поликонденсации происходит то же самое, но помимо полимера получаются еще низкомолекулярные продукты, например, вода. То есть получается два продукта.
Итак, шестое свойство полимеризация. Кетоны в эти реакции не вступают, промышленное значение имеет только полимеризация формальдегида.
Пи-связь рвется и образуются две сигма связи с соседними мономерами. Получается полиформальдегид, называемый также параформ. Вероятнее всего, вопрос на экзамене может звучать так: в реакции полимеризации вступают вещества. И приведен список веществ, среди которых может быть в формальдегид.
Седьмое свойство поликонденсация. Еще раз: при поликонденсации помимо полимера получается еще низкомолекулярное соединение, например, вода. Формальдегид вступает в такую реакцию с фенолом. Для наглядности сначала запишем уравнение с двумя молекулами фенола.

В результате получается такой димер и отщепляется молекула воды. Теперь запишем уравнение реакции в общем виде.

Продуктом поликонденсации является феноло-формальдегидная смола. Она находит широкое применение от клеев и лаков до пластмасс и компонента древесно-стружечных плит.
Теперь третья группа свойств реакции окисления.
3. Окисление альдегидов и кетонов
Восьмой реакцией в общем списке является качественная реакция на альдегидную группу окисление аммиачным раствором оксида серебра. Реакция «серебряного зеркала». Скажу сразу, кетоны не вступают в эту реакцию, только альдегиды.

Альдегидная группа окисляется до карбоксильной, кислотной группы, но в присутствии аммиака, который является основание, сразу же происходит реакция нейтрализации и получается соль ацетат аммония. Серебро выпадает в осадок, покрывая пробирку изнутри и создавая зеркальную поверхность. Эта реакция встречается на ЕГЭ постоянно.
Кстати, эта же реакция является качественной на другие вещества, имеющие альдегидную группу, например, на муравьиную кислоту и ее соли, а также на глюкозу.
Девятая реакция тоже качественная на альдегидную группу окисление свежеосажденным гидроксидом меди два. Здесь тоже замечу, что кетоны не вступают в эту реакцию.

Визуально будет наблюдаться сначала образование желтого осадка, который потом становится красным. В некоторых учебниках встречается информация, что сначала образуется гидроксид меди один, имеющий желтый цвет, который затем распадается на красный оксид меди один и воду. Так вот это неверно по последним данным в процессе выпадения осадка меняется размер частиц оксида меди один, которые в конечном счете достигают размеров, окрашенных именно в красный цвет. Альдегид окисляется до соответствующей карбоновой кислоты. Реакция встречается на егэ очень часто.
Десятая реакция окисление альдегидов подкисленным раствором перманганата калия при нагревании.
Происходит обесцвечивание раствора. Альдегидная группа окисляется до карбоксильной, то есть альдегид окисляется до соответствующей кислоты. Для кетонов эта реакция не имеет практического смысла, поскольку происходит разрушение молекулы и в результате получается смесь продуктов.
Важно отметить, что муравьиный альдегид, формальдегид, окисляется до углекислого газа, потому как соответствующая ему муравьиная кислота сама не устойчива к действию сильных окислителей.
В итоге углерод переходит из степени окисления 0 в степень окисления +4. Напомню, что и метанол, как правило, в таких условиях окисляется по максимуму до CO 2 , проскакивая стадию и альдегида, и кислоты. Эту особенность надо запомнить.
Одиннадцатая реакция горение, полное окисление. И альдегиды, и кетоны сгорают до углекислого газа и воды.
Запишем уравнение реакции в общем виде.
По закону сохранения массы атомов слева должно быть столько же, сколько атомов справа. Потому что ведь в химических реакциях атомы никуда не деваются, а просто изменяется порядок связей между ними. Так вот молекул углекислого газа будет столько же, сколько и атомов углерода в молекуле карбонильного соединения, поскольку в состав молекулы входит один атом углерода. То есть n молекул CO 2 . Молекул воды будет в два раза меньше, чем атомов водорода, то есть 2n/2, а значит просто n.
Атомов кислорода слева и справа одинаковое количество. Справа их 2n из углекислого газа, потому что в каждой молекуле два атома кислорода, плюс n воды, итого 3n. Слева атомов кислорода столько же 3n, но один из атомов находится в молекуле альдегида, значит его надо вычесть из общего количества, чтобы получить количество атомов, приходящихся на молекулярный кислород. Выходит 3n-1 атомов содержит молекулярный кислород, а значит молекул в 2 раза меньше, потому как в состав одной молекулы входят 2 атома. То есть (3n-1)/2 молекул кислорода.
Таким образом, мы составили уравнение сгорания карбонильных соединений в общем виде.
И, наконец, двенадцатое свойство, относящееся к реакциям замещения галогенирование по альфа-атому углерода. Еще раз обратимся к строению молекулы альдегида. Кислород оттягивает на себя электронную плотность, создавая частичный положительный заряд а углероде. Метильная группа пытается компенсировать этот положительный заряд, смещая к нему электроны от водорода по цепи сигма-связей. Связь углерод-водород становится более полярной и водород легче отрывается при атаке реагентом. Такой эффект наблюдается только для альфа-атома углерода, то есть атома следующего за альдегидной группой, вне зависимости от длины углеводородного радикала.
Таким образом, возможно получение, например, 2-хлорацетальдегида. Возможно дальнейшее замещение атомов водорода до трихлорэтаналя.
Альдегиды и их химические свойства
Альдегидами называют такие органические вещества, в молекулах которых есть карбонильная группа, связанная, минимум, с одним атомом водорода и углеводородным радикалом.
Химические свойства альдегидов предопределяются в их молекуле наличием карбонильной группы. В связи с этим в молекуле карбонильной группы можно наблюдать реакции присоединения.
Так, например, если взять и пропустить пары формальдегида разом с водородом над разогретым никелевым катализатором, то произойдет присоединение водорода и формальдегид восстановиться в метиловый спирт. Кроме этого полярный характер данной связи порождает и такую реакцию альдегидов, как присоединение воды.
А теперь давайте рассмотрим все особенности реакций от присоединения воды. Следовало бы отметить, что к углеродному атому карбонильной группы, который несет частичный положительный заряд, благодаря электронной паре кислородного атома, добавляется гидроксильная группа.

При таком присоединении характерны следующие реакции:
Во-первых, происходит гидрирование и образуются первичные спирты RСН2ОН.
Во-вторых, происходит добавление спиртов и образование полуацеталей R-СН (ОН) – ОR. А в присутствии хлороводорода НСl, выступающего катализатором и при излишке спирта мы наблюдаем образование ацетали RСН (ОR)2;
В-третьих, происходит добавление гидросульфита натрия NаНSO3 и образуются производные гидросульфитных альдегидов. При окислении альдегидов можно наблюдать такие особенные реакции, как взаимодействие с аммиачным раствором оксида серебра (I) и с гидроксидом меди (II) и образование карбоновых кислот.
При полимеризации альдегидов характерны такие особенные реакции, как линейная и циклическая полимеризация.
Если говорить о химических свойствах альдегидов, следует упомянуть и реакцию окисления. К таким реакциям можно отнести реакцию «серебряного зеркала» и реакцию светофор.
Пронаблюдать за необычной реакцией «серебряного зеркала» можно, проведя в классе интересный опыт. Для этого вам понадобиться чисто вымытая пробирка, в которую следует налить несколько миллилитров аммиачного раствора оксида серебра, а потом к нему добавить четыре или пять капель формалина. Следующим этапом при проведении этого опыта нужно пробирку поместить в стакан с горячей водой и тогда вы сможете увидеть, как на стенках пробирки появляется блестящий слой. Это образовавшееся покрытие является осадком металлического серебра.

А вот так называемая реакция «светофор»:

Физические свойства альдегидов
Теперь давайте приступим к рассмотрению физических свойств альдегидов. Какими же свойствами обладают эти вещества? Следует обратить внимание на то, что ряд простых альдегидов являют из себя бесцветный газ, более сложные представлены в виде жидкости, а вот высшие альдегиды – это твердые вещества. Чем больше молекулярная масса альдегидов, тем выше температура кипения. Так, например, пропионовый альдегид достигает точки кипения при 48,8 градусов, а вот пропиловый спиртзакипает при 97,8 0С.
Если говорить о плотности альдегидов, то она меньше единицы. Так, например, уксусный и муравьиный альдегид имеет свойство неплохо растворяться в воде, а более сложные альдегиды имеют более слабую способность к растворению.
Альдегиды, которые относятся к низшему разряду, имеют резкий и неприятный запах, а твердые и нерастворимые в воде, наоборот характеризуются приятным цветочным запахом.
Нахождение альдегидов в природе
В природе, повсеместно встречаются представители различных групп альдегидов. Они присутствуют в зеленых частях растений. Эта одна из простейших групп альдегидов, к которым относится муравьиный альдегид СН2О.
Также встречаются альдегиды с более сложным составом. К таким видам относятся ванилин или виноградный сахар.
Но так как альдегиды обладают способностью легко вступать во всякие взаимодействия, имеют склонность к окислению и восстановлению, то можно с уверенностью сказать, что альдегиды очень способны к различным реакциям и поэтому в чистом виде они встречаются крайне редко. А вот их производные можно встретить повсеместно, как в растительной среде, так и животной.

Применение альдегидов
Альдегидная группа присутствует в целом ряде природных веществ. Их отличительной чертой, по крайней мере, многих из них, является запах. Так, например представители высших альдегидов, владеют различными ароматами и входят в состав эфирных масел. Ну и, как вам уже известно, такие масла присутствуют в цветочных, пряных и душистых растениях, плодах и фруктах. Они отыскали масштабное использование в производстве промышленных товаров и при производстве парфюмерии.
Алифатический альдегид СН3(СН2)7С(Н)=О можно найти в эфирных маслах цитрусовых. Такие альдегиды имеют запах апельсина, и применяется в пищевой промышленности, как ароматизатор, а также в косметике, парфюмерии и бытовой химии, в качестве отдушки.
Муравьиный альдегид – это бесцветный газ, который имеет резкий специфический запах и легко растворяется в воде. Такой водный раствор формальдегида еще называют формалином. Формальдегид очень ядовит, но в медицине его применяют в разбавленном виде в качестве дезинфицирующего средства. Его используют для дезинфекции инструментов, а его слабый раствор используют для обмывания кожи при сильной потливости.
Кроме того, формальдегид используют при дублении кожи, так как он имеет способности соединяться белковыми веществами, которые имеются в составе кожи.
В сельском хозяйстве формальдегид прекрасно зарекомендовал себя при обработке зерна перед посевными работами. Его применяют для производства пластмасс, которые так необходимы для техники и бытовых нужд.
Уксусный альдегид являет из себя бесцветную жидкость, которая имеет запах прелых яблок и легко растворяется в воде. Применяется он для получения уксусной кислоты и других веществ. Но так как он является ядовитым веществом, то может вызвать отравление организма или воспаление слизистых оболочек глаз и дыхательных путей.
Лекция № 11
АЛЬДЕГИДЫ И КЕТОНЫ
План
1. Методы получения.
2. Химические свойства.
2.1. Реакции нуклеофильного
присоединения.
2.2. Реакции по a -углеродному атому.
2.3.
Лекция № 11
АЛЬДЕГИДЫ И КЕТОНЫ
План
1. Методы получения.
2. Химические свойства.
2.1. Реакции нуклеофильного
присоединения.
2.2. Реакции по a -углеродному атому.
2.3. Реакции окисления и восстановления.
Альдегиды и кетоны содержат карбонильную группу
С=О. Общая формула:
1. Методы получения.

2. Химические
свойства.
Альдегиды и кетоны – один из наиболее реакционноспособных классов
органических соединений. Их химические свойства определяются присутствием
карбонильной группы. Вследствие большого различия в электроотрицательностях
углерода и кислорода и высокой поляризуемости p
-связи связь С=О обладает значительной полярностью
( m
С=О
=2,5-2,8 D). Атом углерода карбонильной
группы несет эффективный положительный заряд и является объектом для атаки
нуклеофилов. Основной тип реакций альдегидов и кетонов – реакции
нуклеофильного присоединения Ad
N . Кроме того, карбонильная группа оказывает влияние на
реакционную способность связи С-Н в
a
-положении, повышая ее кислотность.
Таким образом, молекулы альдегидов и кетонов
содержат два основных реакционных центра – связь С=О и связь С-Н в
a
-положении:

2.1. Реакции нуклеофильного
присоединения.
Альдегиды и кетоны легко присоединяют нуклеофильные реагенты по С=О связи.
Процесс начинается с атаки нуклеофила по карбонильному атому углерода. Затем
образующийся на первой стадии тетраэдрический интермедиат присоединяет протон и
дает продукт присоединения:

Активность карбонильных соединений в
Ad
N –реакциях зависит от величины
эффективного положительного заряда на карбонильном атоме углерода и объема
заместителей у карбонильной группы. Электронодонорные и объемистые заместители
затрудняют реакцию, электроноакцепторные заместители повышают реакционную
способность карбонильного соединения. Поэтому альдегиды в
Ad
N –реакциях активнее, чем
кетоны.
Активность карбонильных соединений повышается в
присутствии кислотных катализаторов, которые увеличивают положительный заряд на
карбонильном атоме углерода:

Альдегиды и кетоны присоединяют воду, спирты,
тиолы, синильную кислоту, гидросульфит натрия, соединения типа
NH
2 X. Все реакции присоединения
идут быстро, в мягких условиях, однако образующиеся продукты, как правило,
термодинамически не устойчивы. Поэтому реакции протекают обратимо, и содержание
продуктов присоединения в равновесной смеси может быть низким.
Присоединение воды.
Альдегиды и кетоны присоединяют воду с
образованием гидратов. Реакция протекает обратимо. Образующиеся гидраты
термодинамически не стабильны. Равновесие смещено в сторону продуктов
присоединения только в случае активных карбонильных соединений.

Продукт гидратации трихлоруксусного альдегида
хлоральгидрат – устойчивое кристаллическое соединение, которое используется в
медицине как успокаивающее и снотворное средство.
Присоединение спиртов и
тиолов.
Альдегиды присоединяют спирты с образованием полуацеталей
. При избытке спирта и в присутствии кислотного катализатора
реакция идет дальше – до образования ацеталей

Реакция образования полуацеталя протекает как
нуклеофильное присоединение и ускоряется в присутствии кислот или
оснований.

Процесс образования ацеталя идет как
нуклеофильное замещение ОН группы в полуацетале и возможен только в условиях
кислотного катализа, когда группа ОН превращается в хорошую уходящую группу
(H
2 O).

Образование ацеталей – обратимый процесс. В
кислой среде полуацетали и ацетали легко гидролизуются. В щелочной среде
гидролиз не идет. Реакции образования и гидролиза ацеталей играют важную роль в
химии углеводов.
Кетоны в аналогичных условиях кеталей не
дают.
Тиолы как более сильные нуклеофилы, чем спирты,
образуют продукты присоединения и с альдегидами, и с кетонами.
Присоединение синильной
кислоты
Синильная кислота присоединяется к карбонильным соединением в условиях
основного катализа с образованием циангидринов.

Реакция имеет препаративное значение и
используется в синтезе
a
-гидрокси- и
a
-аминокислот (см. лек. № 14). Плоды некоторых растений
(например, горький миндаль) содержат циангидрины. Выделяющаяся при их
расщеплении синильная кислота оказывает отравляющее действие
.
Присоединение бисульфита
натрия.
Альдегиды и метилкетоны присоединяют бисульфит натрия NaHSO 3 c образованием бисульфитных производных.

Бисульфитные производные карбонильных соединений
– кристаллические вещества, не растворимые в избытке раствора бисульфита натрия.
Реакция используется выделения карбонильных соединений из смесей. Карбонильное
соединение может быть легко регенерировано обработкой бисульфитного производного
кислотой
или щелочью.
Взаимодействие с соединениями общей
формулы NH
2 X.
Реакции протекают по общей схеме как процесс
присоединения-отщепления. Образующийся на первой стадии продукт присоединения не
устойчив и легко отщепляет воду.

По приведенной схеме с карбонильными
соединениями реагируют аммиак, первичные амины, гидразин, замещенные гидразины,
гидроксиламин.

Образующиеся производные представляют собой
кристаллические вещества, которые используют для выделения и идентификации
карбонильных соединений.
Имины (основания Шиффа) являются промежуточными
продуктами во многих ферментативных процессах (трансаминирование под действием
кофермента пиридоксальфосфата; восстановительное аминирование кетокислот при
участии кофермента НАД
Н). При каталитическом гидрировании иминов образуются
амины. Процесс используется для синтеза аминов из альдегидов и кетонов и
называется восстановительным аминированием.
Восстановительное аминирование протекает in vivo
в ходе синтеза аминокислот (см. лек. № 16)
2.2. Реакции по a -углеродному атому.
Кето-енольная таутомерия.
Водород в
a
-положении к карбонильной группе обладает кислотными
свойствами, так как образующийся при его отщеплении анион стабилизируется за
счет резонанса.

Результатом протонной подвижности атома водорода
в
a
-положении
является способность карбонильных соединений к образованию енольных форм за счет
миграции протона из
a
-положения к атому кислорода карбонильной группы.

Кетон и енол являются таутомерами
.
Таутомеры – это изомеры, способные быстро и обратимо превращаться друг в друга
за счет миграции какой-либо группы (в данном случае – протона). Равновесие между
кетоном и енолом называют кето-енольной таутомерией.
Процесс енолизации катализируется кислотами и
основаниями. Енолизация под действием основания может быть представлена
следующей схемой:
Большинство карбонильных соединений существуют
преимущественно в кетонной форме. Содержание енольной формы возрастает с
увеличением кислотности карбонильного соединения, а также в случае
дополнительной стабилизации енольной формы за счет водородной связи или за счет
сопряжения.
Таблица 8. Содержание енольных форм и
кислотность карбонильных соединений
Например, в 1,3-дикарбонильных соединениях
подвижность протонов метиленовой группы резко увеличивается за счет
электроноакцепторного влияния двух карбонильных групп. Кроме того, енольная
форма стабилизируется за счет наличия в ней системы сопряженных
p
-связей и внутримолекулярной
водородной связи.

Если соединение в енольной форме представляет
собой сопряженную систему с высокой энергией стабилизации, то енольная форма
преобладает. Например, фенол существует только в енольной форме.
Енолизация и образование енолят-анионов являются
первыми стадиями реакций карбонильных соединений, протекающих по
a
-углеродному атому. Важнейшими
из них являются галогенирование
и альдольно-кротоновая
конденсация
.
Галогенирование.
Альдегиды и кетоны легко вступают в реакцию с галогенами (Cl 2 ,
Br 2 , I 2 ) с образованием
исключительно
a
-галогенпроизводных.

Реакция катализируется кислотами или
основаниями. Скорость реакции не зависит от концентрации и природы галогена.
Процесс протекает через образование енольной формы (медленная стадия), которая
затем реагирует с галогеном (быстрая стадия). Таким образом, галоген не
участвует в скорость
—определяющей стадии
процесса.

Если карбонильное соединение содержит несколько
a
-водородных
атомов, то замещение каждого последующего происходит быстрее, чем предыдущего,
вследствие увеличения их кислотности под действием электроноакцепторного влияния
галогена. В щелочной среде ацетальдегид и метилкетоны дают
тригалогенпроизводные, которые затем расщеплятся под действием избытка щелочи с
образованием тригалогенметанов (галоформная реакция)
.
Расщепление трииодацетона протекает как реакция
нуклеофильного замещения. группы CI
3 — гидроксид-анионом, подобно S
N -реакциям в карбоксильной группе (см. лек. №12).
Иодоформ выпадает из реакционной смеси в виде
бледно-желтого кристаллического осадка с характерным запахом. Иодоформную
реакцию используют в аналитических целях для обнаружения соединений типа
СH
3 -CO-R, в том числе в
клинических лабораториях для диагностики сахарного диабета.
Реакции конденсации.
В присутствии каталитических количеств кислот
или щелочей карбонильные соединения, содержащие
a
-водородные атомы,
претерпевают конденсацию с образованием
b
-гидроксикарбонильных соединений.

В образовании связи С-С участвуют карбонильный
атом углерода одной молекулы (карбонильной компоненты
) и
a
-углеродный атом другой
молекулы (метиленовой компоненты
). Эта реакция носит название альдольной конденсации
(по названию продукта конденсации ацетальдегида –
альдоля).
При нагревании реакционной смеси продукт легко
дегидратируется с образованием
a
,b
-непредельного карбонильного
соединения.

Такой тип конденсации носит название кротоновой
(по названию продукта конденсации ацетальдегида – кротонового
альдегида).
Рассмотрим механизм альдольной конденсации в
щелочной среде. На первой стадии гидроксид-анион отрывает протон из
a
-положения карбонильного
соединения с образованием енолят-аниона. Затем енолят анион как нуклеофил
атакует карбонильный атом углерода другой молекулы карбонильного соединения.
Образующийся тетраэдрический интермедиат (алкоксид-анион) является сильным
основанием и отрывает далее протон от молекулы воды.

При альдольной конденсации двух различных
карбонильных соединений (перекрестная альдольная конденсация) возможно
образование 4-х разных продуктов. Однако этого можно избежать, если одно из
карбонильных соединений не содержит
a
-водородных атомов (например, ароматические альдегиды
или формальдегид) и не может выступать в качестве метиленовой компоненты.

В качестве метиленовой компоненты в реакциях
конденсации могут выступать не только карбонильные соединения, но и другие
С-Н-кислоты. Реакции конденсации имеют препаративное значение, так как позволяют
наращивать цепь углеродных атомов. По типу альдольной конденсации и
ретроальдольного распада (обратный процесс) протекают многие биохимические
процессы: гликолиз, синтез лимонной кислоты в цикле Кребса, синтез нейраминовой
кислоты.
2.3. Реакции окисления и
восстановления
Восстановление
Карбонильные соединения восстанавливаются до
спиртов в результате каталитического гидрирования или под действием
восстановителей, которые являются донорами гидрид-анионов.

[H]: H 2 /кат., кат. – Ni, Pt,
Pd;
LiAlH 4 ; NaBH 4 .
Восстановление карбонильных соединений
комплексными гидридами металлов включает нуклеофильную атаку карбонильной группы
гидрид-анионом. При последующем гидролизе образуется спирт.
Аналогично происходит восстановление
карбонильной группы in vivo под действием кофермента НАД
Н, который является
донором гидрид-иона (см. лек. №19).
Окисление
Альдегиды окисляются очень легко практически
любыми окислителями, даже такими слабыми, как кислород воздуха и соединения
серебра (I) и меди
(II).
Две последние реакции используются как
качественные на альдегидную группу.
В присутствии щелочей альдегиды, не содержащие
a
-водородных атомов
диспропорционируют с образованием спирта и кислоты (реакция Канницаро).
2HCHO + NaOH ® HCOONa + CH 3 OH
Это является причиной того, что водный раствор
формальдегида (формалин) при длительном хранении приобретает кислую
реакцию.
Кетоны устойчивы к действию окислителей в
нейтральной среде. В кислой и щелочной средах под действием сильных
окислителей
(KMnO 4 ) они
окисляются с разрывом связи С-С. Расщепление углеродного скелета происходит по
двойной углерод-углеродной связи енольных форм карбонильного соединения, подобно
окислению двойных связей в алкенах. При этом образуется смесь продуктов,
содержащая карбоновые кислоты или карбоновые кислоты и кетоны.
(для простейшего альдегида R=H)
Классификация альдегидов
По строению углеводородного радикала:
Предельные; например:

Непредельные; например:

Ароматические; например:

Алициклические; например:

Общая формула предельных альдегидов

Гомологический ряд, изомерия, номенклатура

Альдегиды изомерны другому классу соединений - кетонам

например:

Альдегиды и кетоны содержат карбонильную группу ˃C=O, поэтому называются карбонильными соединениями.
Электронное строение молекул альдегидов
Атом углерода альдегидной группы находится в состоянии sp 2 -гибридизации, поэтому все σ-связи в этой группе располагаются в одной плоскости. Облака р-электронов, образующих π-связь, перпендикулярны этой плоскости и легко смещаются к более электроотрицательному атому кислорода. Поэтому двойная связь C=O (в отличие от двойной связи C=C в алкенах) сильно поляризована.
Физические свойства

Химические свойства
Альдегиды - реакционноспособные соединения, вступающие в многочисленные реакции. Наиболее характерны для альдегидов:
а) реакции присоединения по карбонильной группе; реагенты типа НХ присоединяются следующим образом:

б) реакции окисления связи C-H альдегидной группы, в результате которых образуются карбоновые кислоты:
I. Реакции присоединения
1. Гидрирование (образуются первичные спирты

2. Присоединение спиртов (образуются полуацетали и ацетали)

В избытке спирта в присутствии HCl полуацетали превращаются в ацетали:

II. Реакции окисления
1. Реакция «серебряного зеркала»

Упрощённо:

Эта реакция является качественной реакцией на альдегидную группу (на стенках реакционного сосуда образуется зеркальный налет металлического серебра).
2. Реакция с гидроксидом меди (II)

Эта реакция также является качественной реакцией на альдегидную групп у (выпадает красный осадок Сu 2 O).
Формальдегид окисляется различными O-содержащими окислителями сначала до муравьиной кислоты и далее - до Н 2 СO 3 (СO 2 + Н 2 O):

III. Реакции ди-, три- и полимеризации
1. Альдольная конденсация

2. Тримеризация ацетальдегида

3. Полимеризация формальдегида
При длительном хранении формалина (40%-ный водный раствор формальдегида) в нем происходит полимеризация с образованием белого осадка параформа:

IV. Реакция поликонденсации формальдегида с фенолом

 Виды грамматических навыков
Виды грамматических навыков Технологическая карта урока как инновационный инструмент реализации фгос роговцева наталья ивановна, к
Технологическая карта урока как инновационный инструмент реализации фгос роговцева наталья ивановна, к Жанна д’Арк: героиня или грандиозный пиар-проект?
Жанна д’Арк: героиня или грандиозный пиар-проект?